��Ŀ����
����Ŀ�������Ƿ�չ�е�����Դ���������ð�������Ʊ��������Ӧ���������ڡ��ش��������⣺
(1)��������ȣ�������һ�ָ�������ȼ�ϣ���������ֱ��ȼ�յ�����ת����Զ����ȼ�ϵ�أ�д����������ȼ�ϵ�صĸ�����Ӧʽ��______��
(2)����̫����ֱ�ӷֽ�ˮ���⣬�����������������;����������ת����ʽΪ______���Ȼ�ѧ����ʽ�練Ӧ����ʾ�����ⷴӦ�ڢ�Ҳ���Ի�ȡ![]() ��
��
��̫������ֽ�ˮ���⣺![]()
![]()
�ڽ�̿��ˮ��Ӧ���⣺![]()
![]()
�ۼ�����ˮ��Ӧ���⣺![]()
��Ӧ![]() ��
��![]() ______��
______��
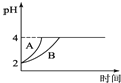
(3)�ں��º��ݵ��ܱ������У�ij���ⷴӦ��![]() �ﵽ��ѧƽ�⡣�����й�������ȷ����______��
�ﵽ��ѧƽ�⡣�����й�������ȷ����______��
![]() ����������ټ�������
����������ټ�������![]() ����
����![]() ת��������
ת��������
![]() ʹ�ô������Լӿ췴Ӧ���ʣ��������Ч��
ʹ�ô������Լӿ췴Ӧ���ʣ��������Ч��
![]() ����
����![]() ֻ��
ֻ��![]()
![]() ����������ѹǿ���ֲ���
����������ѹǿ���ֲ���
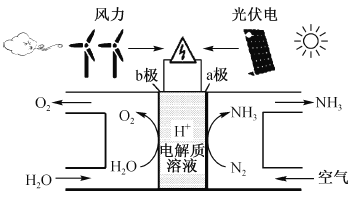
(4)������������ֱ�ӻ����Ʊ��������⣬��һ�־��л��������ֱ�ӡ����;��õĺϳɹ�������ķ������乤���ص���Ҫ����ˮ����Ӧ���ʣ�����̿Ϊ�����![]() �����������ʵ����������ϳ�ʱ�ڷ�Ӧ���м���ϡ�ͼ�����
�����������ʵ����������ϳ�ʱ�ڷ�Ӧ���м���ϡ�ͼ�����![]() ��
��![]() ��Ar����˵����Ҫ����ϡ�ͼ���ԭ��______�������ڴ˷��ϳɹ�������Ĺ�����������һЩ����Ӧ���²��ʵĽ��ͣ���д��һ������Ӧ�Ļ�ѧ����ʽ______��
��Ar����˵����Ҫ����ϡ�ͼ���ԭ��______�������ڴ˷��ϳɹ�������Ĺ�����������һЩ����Ӧ���²��ʵĽ��ͣ���д��һ������Ӧ�Ļ�ѧ����ʽ______��
(5)�������ϵ�����ػ�����ֳƣ������������������������ҹ����Ƶ�һ���Դ��͵���Һ�����ػ�������ʹ������Һ��Ϊȼ�ռ�������Ϊ�������ĸ����ƽ�������֪��
��![]()
��![]()
���йع�����ͼ��
��д�����Һ��ȼ�յ��Ȼ�ѧ����ʽ��______��
���𰸡�![]() ����ת��Ϊ��ѧ��
����ת��Ϊ��ѧ�� ![]() bd ����
bd ����![]() ��
��![]() �ı�������ֹ����������ȱ�ը
�ı�������ֹ����������ȱ�ը ![]()
![]()
![]() ��
��![]()
![]()
![]()
![]()
��������
(1)��������ȼ�ϵ�صĸ�����ӦʽΪ����ʧȥ��������ˮ����������ȼ�ϵ�صĸ�����ӦʽΪ![]() ��
��
(2)��֪��
��C(s)+H2O(g)��CO(g)+H2(g)��H2��+131.3kJ/mol
��CH4(g)+H2O(g)��CO(g)+3H2(g)��H3��+206.1kJ/mol
��ϸ�˹���ɼ����-�ڵõ���ӦCH4(g)��C(s)+2H2(g)��H��+74.8 kJ/mol��
(3)MHx(s)+yH2(g)![]() MHx+2y(s)��H��0���÷�Ӧ������������ʵ��������仯�ķ�Ӧ����
MHx+2y(s)��H��0���÷�Ӧ������������ʵ��������仯�ķ�Ӧ����
a������������ټ�������MHx(s)Ϊ���壬��Ӱ�컯ѧƽ�⣬H2ת���ʲ��䣬��a����
b��ʹ�ô������Լӿ췴Ӧ���ʣ����̴ﵽƽ������ʱ�䣬�������Ч�ʣ���b��ȷ��
c���÷�ӦΪ���淴Ӧ��������ȫת��������ymolH2�����1molMHx����c����
d��ƽ��ʱ��������ʵ������䣬����������ѹǿ���ֲ��䣬��d��ȷ��
�ʴ�Ϊbd��
(4)������������ֱ�ӻ����Ʊ��������⣬�ϳ�ʱ�ڷ�Ӧ���м���ϡ�ͼ�����N2��CO2��Ar����Ҫ����ϡ�ͼ���ԭ���ǣ�����H2��O2�ı�������ֹ����������ȱ�ը���ڴ˷��ϳɹ�������Ĺ�����������һЩ����Ӧ���²��ʵĽ��ͣ���������������Ӧ����ˮ����������ֽ�ȣ���ѧ����ʽΪ��![]()
![]()
![]() ��
��![]()
![]()
![]() ��
��
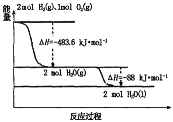
(5)��ͼ�������2H2(g)+O2(g)=H2O(g)��H1��-483.6kJmol1��
H2(g)��H2(l)��H2��-0.92kJmol1��
O2(g)��O2(l)��H3��-6.84kJmol1��
���ݸ�˹���ɣ�����-�ڡ�2-�ۿɵ�2H2(l)+O2(l)=2H2O(g)��H��-474.92kJmol1��