题目内容
【题目】Ⅰ.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素知识回答问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是_________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素为__________(填名称);氧化性最弱的简单阳离子是________________(填离子符号)。
(3)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是_________(填字母)。
a.NH3 b.HI c.SO2 d.CO2
(4)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:__________。
Ⅱ.氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙,甲和乙是二元化合物。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L H2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物, 该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(5)甲的化学式是___________________;乙的电子式是___________。
(6)甲与水反应的化学方程式是______________________。
(7)判断:甲与乙之间____________(填“可能”或“不可能”)发生反应产生H2。
【答案】b 氩 Na+ b 4KClO3![]() KCl+3KClO4 AlH3
KCl+3KClO4 AlH3 ![]() 2AlH3+6H2O═2Al(OH)3+6H2↑ 可能
2AlH3+6H2O═2Al(OH)3+6H2↑ 可能
【解析】
Ⅰ. (1) 根据同周期元素性质递变规律回答;
(2)第三周期的元素,次外层电子数是8;
(3)浓硫酸是酸性干燥剂,具有强氧化性,不能干燥碱性气体、还原性气体;P2O5是酸性氧化物,是非氧化性干燥剂,不能干燥碱性气体;
(4)根据题干信息可知该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐,最后根据化合价升降相等配平即可;
Ⅱ.甲加热至完全分解,只得到一种短周期元素的金属单质和H2,说明甲是金属氢化物,甲与水反应也能产生H2,同时还产生一种白色沉淀物, 该白色沉淀可溶于NaOH溶液,说明含有铝元素;化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,则乙是非金属气态氢化物,丙在标准状态下的密度1.25 g/L,则单质丙的摩尔质量M=1.25 g/L×22.4 L/mol=28 g/mol,丙为氮气,乙为氨气。
(1)
a.同周期的元素从左到右,原子半径依次减小,金属元素形成的阳离子半径比非金属元素形成阴离子半径小,如r(Na+)<r(Cl-),故a错误;
b. 同周期的元素从左到右,金属性减弱,非金属性增强,故b正确;
c. 同周期的元素从左到右,最高价氧化物对应的水化物碱性减弱,酸性增强,故c错误;
d.单质的熔点可能升高,如钠的熔点比镁的熔点低,故d错误。选b。
(2)第三周期的元素,次外层电子数是8,最外层电子数与次外层电子数相同的元素为氩;元素金属性越强,简单阳离子的氧化性越弱,所以第三周期元素氧化性最弱的简单阳离子是Na+;
(3)浓硫酸是酸性干燥剂,具有强氧化性,不能用浓硫酸干燥NH3、HI;P2O5是酸性氧化物,是非氧化性干燥剂,不能干燥NH3;所以不能用浓硫酸干燥,可用P2O5干燥的是HI,选b;
(4)若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3![]() KCl+3KClO4。
KCl+3KClO4。
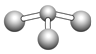
(5)根据以上分析,甲是铝的氢化物,Al为+3价、H为-1价,化学式是AlH3;乙为氨气,氨气的电子式是![]() 。
。
(6) AlH3与水反应生成氢氧化铝和氢气,反应的化学方程式是2AlH3+6H2O═2Al(OH)3+6H2↑。
(7) AlH3中含-1价H,NH3中含+1价H,可发生氧化还原反应产生H2。

【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
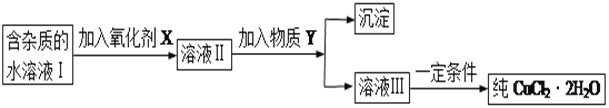
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)