题目内容
【题目】下列图示与对应的叙述相符合的是( )
A.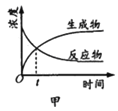 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态
B.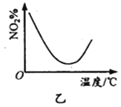 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)
图乙表示NO2在恒容密闭容器中发生反应:2NO2(g) ![]() N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<0
C.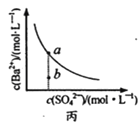 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点
D.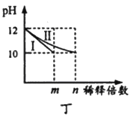 图丁表示分别稀释10 mL pH均为12的NaOH和NH3H2O溶液时pH的变化,曲线I表示NH3H2O溶液,n>100
图丁表示分别稀释10 mL pH均为12的NaOH和NH3H2O溶液时pH的变化,曲线I表示NH3H2O溶液,n>100
【答案】B
【解析】
A. t时反应物和生成物的浓度相等,而不是不变;
B. 升高温度,题中图象曲线变化先减小后增大,减小部分没有达到平衡,增大部分说明升高温度,平衡左移,NO2体积分数增大;
C. 蒸发水时溶液体积减小,则硫酸根浓度也增大;
D. NH3H2O是弱电解质,在水溶液里存在电离平衡,加水稀释促进NH3H2O电离。
A. t时反应物和生成物的浓度相等,而不是不变,所以t时未处于平衡状态,A错误;
B. 升高温度,题中图象曲线变化先减小后增大,减小部分是反应正向进行速率加快而消耗,没有达到平衡,当达到最低点后升高温度,NO2体积分数增大,说明升高温度化学平衡逆向移动,逆反应为吸热反应,因此以该反应的正反应△H<0,B正确;
C. 蒸发水时溶液体积减小,则Ba2+、SO42-的浓度都增大,所以蒸发水不能使溶液由b点变到a点,C错误;
D. NH3H2O是弱电解质,在水溶液里存在电离平衡,NaOH是一元强碱,完全电离,所以c(NH3H2O)>c(OH-)=c(NaOH),加水稀释促进NH3H2O电离,所以若稀释相同倍数,溶液中c(OH-):氨水大于NaOH,所以若稀释后溶液中c(OH-)相等,NH3H2O稀释倍数就要大于NaOH的稀释倍数,故曲线I表示NaOH溶液,曲线II表示NH3H2O溶液,溶液pH由pH=12变为pH=10,稀释倍数n>100,D错误;
故合理选项是B。