题目内容
【题目】在氢氟酸溶液中,存在如下电离平衡:HFH++F-
(1)加入固体NaOH,电离平衡向______反应方向移动,c(H+)______ .
(2)加入固体NaF,电离平衡向______反应方向移动.
(3)升高温度,电离平衡向______反应方向移动.
(4)常温下,小苏打溶液呈______性,原因是_________________________(用必要的离子方程式及文字解释表示).
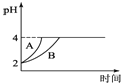
(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是 ______(填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2则m1______m2(选填“>”、“=”“<”)
【答案】正 减小 逆 正 碱 在NaHCO3溶液中存在:HCO3-![]() H++CO32-、HCO3-+H2O
H++CO32-、HCO3-+H2O![]() H2CO3+OH-,由于HCO
H2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,溶液呈碱性 B <
的水解程度大于电离程度,溶液呈碱性 B <
【解析】
在氢氟酸溶液中,存在如下电离平衡:HFH++F-,
(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,氢离子浓度减小,电离平衡向正反应方向移动;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,电离平衡向逆反应方向移动;
(3)弱电解质的电离是吸热的,升高温度,促进氢氟酸电离,电离平衡向正反应方向移动;
(4)在NaHCO3溶液中存在:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,因此小苏打溶液呈碱性;
的水解程度大于电离程度,因此小苏打溶液呈碱性;
(5)醋酸为弱酸,等pH时,醋酸浓度较大,与锌反应时,醋酸进一步电离出氢离子,则醋酸的pH变化较小,醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,pH变化等量时,消耗的锌较多,以此解答。
在氢氟酸溶液中,存在如下电离平衡:HFH++F-,
(1)加入氢氧化钠固体,氢氧化钠和氢离子反应生成水,氢离子浓度减小,电离平衡向正反应方向移动,但溶液中氢离子浓度减小;
故答案为:正;减小;
(2)向溶液中加入氟化钠固体,氟离子浓度增大,抑制氢氟酸电离,电离平衡向逆反应方向移动;
故答案为:逆;
(3)弱电解质的电离是吸热的,升高温度,促进氢氟酸电离,电离平衡向正反应方向移动;
故答案为:正;
(4)在NaHCO3溶液中存在:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,因此小苏打溶液呈碱性;
的水解程度大于电离程度,因此小苏打溶液呈碱性;
故答案为:碱;在NaHCO3溶液存在中:HCO3-H++CO32-、HCO3-+H2OH2CO3+OH-,由于HCO![]() 的水解程度大于电离程度,溶液呈碱性;
的水解程度大于电离程度,溶液呈碱性;
(5)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线;由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2;
故答案为:B;<。

【题目】结合下表回答下列问题:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
溶度积/25 ℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
现有某酸性CuCl2溶液中含有少量的FeCl2,为得到纯净的CuCl2·2H2O晶体,按如图步骤进行提纯:
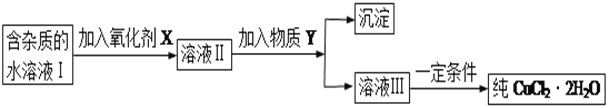
(1)最适合作氧化剂X的是_________(填字母),加入X的目的是____________________________________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是____________(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是______________________________________________________。
(3)含Cr2O![]() 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O![]() ,为了使废水的排放达标,进行如下处理:
,为了使废水的排放达标,进行如下处理:
![]()
①绿矾化学式为FeSO4·7H2O,反应(I)的离子方程式为________________________________;
②若处理后的废水中c(Cr3+)=3.0×10-6 mol·L-1,则废水中c(Fe3+)= _________ mol·L-1。(Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH) 3]=6.0×10-31)