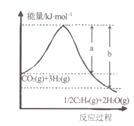
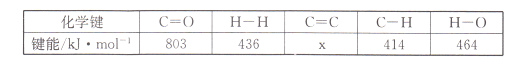
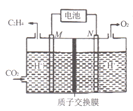
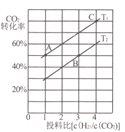
题目内容
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
【答案】B
【解析】
由表格数据可知,250℃时,反应在5min达到化学平衡,300℃时,反应在3 min达到化学平衡。
A、Si3N4为固体,固体的浓度为定值;
B、起始N2和H2的物质的量比值为定值,反应中N2和H2的消耗量的比值恒定为1:3;
C、其他条件相同时,升高温度,反应速率加快;
D、该反应为放热反应,升高温度平衡逆向移动,温度不同,反应物的消耗量不同。
A项、Si3N4为固体,固体的浓度为定值,不能用固体表示化学反应速率,A错误;
B项、起始N2和H2的物质的量比值为定值,反应中N2和H2的消耗量的比值恒定为1:3,则反应达到平衡时, 两种温度下N2和H2的转化率之比相同,B正确;
C项、其他条件相同时,升高温度,反应速率加快,温度越高,反应速率越大,则达到平衡前,300℃条件的反应速率比250℃快,平衡后,300℃依然比250℃快,C错误;
D项、该反应为放热反应,升高温度平衡逆向移动,温度不同,反应物的消耗量不同,则反应放出的热量不同,D错误。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/ kJ·mol-1 | |
硫酸 | 碱溶液 | |||
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(1)实验①中碱液过量的目的是____________________。
(2)甲同学预计ΔH1≠ΔH2,其依据是______________________。
(3)若实验测得①中终了温度为31.8 ℃,则该反应的中和热ΔH1=________(已知硫酸、NaOH溶液密度近似为1.0 g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH________(填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q________。
【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。