ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΒΆΧΦΨ≠ΦΟ≥…ΈΣ»ΥΟ«“Μ÷÷–¬ΒΡ…ζΜνάμΡνΘ§Εΰ―θΜ·ΧΦΒΡ≤ΕΉΫΚΆάϊ”Ο «Ρή‘¥Νλ”ρΒΡ“ΜΗω÷Ί“Σ―–ΨΩΖΫœρΓΘ«κΡψΫαΚœœ¬Ν–”–ΙΊΆΦ ΨΚΆΥυ―ß÷Σ ΕΜΊ¥πΘΚ
IΘ°”ΟCO2¥ΏΜ·Φ”«βΩ…“‘÷Τ»Γ““œ©ΘΚCO2Θ®gΘ©+3H2Θ®gΘ©![]() 1/2C2H4Θ®gΘ©+2H2OΘ®gΘ©ΓΘ
1/2C2H4Θ®gΘ©+2H2OΘ®gΘ©ΓΘ
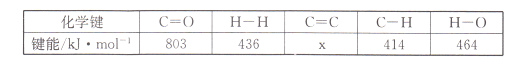
(l)»τΗΟΖ¥”ΠΧεœΒΒΡΡήΝΩΥφΖ¥”ΠΙΐ≥Χ±δΜ·ΙΊœΒ»γΆΦΥυ ΨΘ§‘ρΗΟΖ¥”ΠΓςH =___________Θ®”ΟΚ§aΓΔbΒΡ ΫΉ”±μ ΨΘ©ΘΜ”÷÷ΣΘΚœύΙΊΜ·―ßΦϋΒΡΦϋΡή»γœ¬±μΥυ ΨΘ§ Β―ι≤βΒΟ…œ ωΖ¥”ΠΒΡΓςH =-152 kJ/molΘ§‘ρ±μ÷–ΒΡx= ___ΓΘ
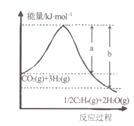
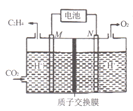
(2)“‘œΓΝρΥαΈΣΒγΫβ÷ »ή“ΚΘ§άϊ”ΟΧΪ―τΡήΒγ≥ΊΫΪCO2ΉΣΜ·ΈΣ““œ©ΒΡΙΛΉς‘≠άμ»γΆΦΥυ ΨΓΘ‘ρMΦΪ…œΒΡΒγΦΪΖ¥”Π ΫΈΣ____ΓΘ
IIΘ°”ΟCO2¥ΏΜ·Φ”«βΜΙΩ…“‘÷Τ»ΓΕΰΦΉΟ―ΘΚ2CO2Θ®gΘ©+6H2Θ®gΘ©![]() CH3OCH3Θ®gΘ©+3H2OΘ®gΘ©ΓςH =-122.5kJ/molΘ§Ρ≥―Ι«Ωœ¬Θ§Κœ≥…ΕΰΦΉΟ―ΒΡΖ¥”Π‘Ύ≤ΜΆ§Έ¬Ε»ΓΔ≤ΜΆ§ΆΕΝœ±» ±Θ§CO2ΒΡΤΫΚβΉΣΜ·¬ »γΆΦΥυ ΨΓΘ
CH3OCH3Θ®gΘ©+3H2OΘ®gΘ©ΓςH =-122.5kJ/molΘ§Ρ≥―Ι«Ωœ¬Θ§Κœ≥…ΕΰΦΉΟ―ΒΡΖ¥”Π‘Ύ≤ΜΆ§Έ¬Ε»ΓΔ≤ΜΆ§ΆΕΝœ±» ±Θ§CO2ΒΡΤΫΚβΉΣΜ·¬ »γΆΦΥυ ΨΓΘ
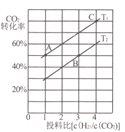
(3)ΆΦ÷–T1ΓΔT2Ζ÷±π±μ ΨΖ¥”ΠΈ¬Ε»Θ§≈–ΕœT1ΓΔT2¥σ–ΓΙΊœΒΒΡ“άΨί «____ΘΜΆΦ÷–AΓΔBΓΔC»ΐΒψΕ‘”ΠΒΡΤΫΚβ≥Θ ΐΖ÷±πΈΣKAΓΔKBΓΔKcΘ§Τδ»ΐ’Ώ¥σ–ΓΒΡΙΊœΒ «____ΓΘ
(4)T1Έ¬Ε»œ¬Θ§ΫΪ6molCO2ΚΆ12molH2≥δ»κ2LΒΡΟή±’»ίΤς÷–Θ§Ψ≠Ιΐ5minΖ¥”Π¥οΒΫΤΫΚβΘ§‘ρ0ΓΪ5minΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ Π‘(H2)=_______Θ§ΤΫΚβ≥Θ ΐK=__Θ®Ν–≥ωΦΤΥψ ΫΦ¥Ω…Θ©ΓΘ
ΓΨ¥πΑΗΓΩ-Θ®b-aΘ©kJmol-1 764 kJmol-1 2CO2+12e-+12H+=C2H4+4H2O ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§CO2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΗυΨίΆΦœώ÷Σ‘ΎΆΕΝœ±»œύΆ§ ±Θ§T1ΤΫΚβ ±CO2ΒΡΉΣΜ·¬ ¥σ”ΎT2Θ§‘ρT1<T2 KA=KcΘΨKB 1.08 mol/Θ®LΓΛminΘ© ![]()
ΓΨΫβΈωΓΩ
Θ®1Θ©”…ΆΦ÷ΣΖ¥”ΠΈοΉήΡήΝΩ¥σ”Ύ…ζ≥…ΈοΉήΡήΝΩΘ§ΗΟΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘΜ“άΨίΖ¥”Π»»ΠΛH=Ζ¥”ΠΈοΒΡΦϋΡήΉήΚΆ-…ζ≥…ΈοΒΡΦϋΡήΉήΚΆΦΤΥψxΘΜ
Θ®2Θ©ΗυΨίΆΦ ΨΘ§‘ΎMΒγΦΪ…œCO2ΖΔ…ζΒΟΒγΉ”ΒΡΜΙ‘≠Ζ¥”Π…ζ≥…C2H4Θ§MΒγΦΪΈΣ“θΦΪΘΜ
Θ®3Θ©ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·ΘΜΈ¬Ε»≤Μ±δΘ§Μ·―ßΤΫΚβ≥Θ ΐ≤Μ±δΘ§…ΐΗΏΈ¬Ε»Θ§Μ·―ßΤΫΚβ≥Θ ΐΦθ–ΓΘΜ
Θ®4Θ©Ϋ®ΝΔ»ΐΕΈ ΫΘ§“άΨί»ΐΕΈ ΫΦΤΥψΖ¥”ΠΥΌ¬ ΚΆΤΫΚβ≥Θ ΐΓΘ
Θ®1Θ©”…ΆΦ÷ΣCO2Θ®gΘ©+3H2Θ®gΘ©ΨΏ”–ΒΡΉήΡήΝΩ¥σ”Ύ1/2C2H4Θ®gΘ©+2H2OΘ®gΘ©ΨΏ”–ΒΡΉήΡήΝΩΘ§ΗΟΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§Ζ¥”ΠΒΡΠΛH=…ζ≥…ΈοΨΏ”–ΒΡΉήΡήΝΩ-Ζ¥”ΠΈοΨΏ”–ΒΡΉήΡήΝΩ=-Θ®b-aΘ©kJ/molΘΜΖ¥”Π»»ΠΛH=Ζ¥”ΠΈοΒΡΦϋΡήΉήΚΆ-…ζ≥…ΈοΒΡΦϋΡήΉήΚΆ=2EΘ®C=OΘ©+3EΘ®H-HΘ©-[1/2EΘ®C=CΘ©+2EΘ®C-HΘ©+4EΘ®H-OΘ©]=2ΓΝ803kJ/mol+3ΓΝ436kJ/mol-[1/2x+2ΓΝ414kJ/mol+
4ΓΝ464kJ/mol]=-152kJ/molΘ§ΫβΒΟx=764kJ/molΘ§Ι ¥πΑΗΈΣΘΚ-Θ®b-aΘ©kJmol©¹1ΘΜ764 kJmol©¹1ΘΜ
Θ®2Θ©ΗυΨίΆΦ ΨΘ§‘ΎMΒγΦΪ…œCO2ΖΔ…ζΒΟΒγΉ”ΒΡΜΙ‘≠Ζ¥”Π…ζ≥…C2H4Θ§MΒγΦΪΈΣ“θΦΪΘ§ΒγΦΪΖ¥”Π ΫΈΣ2CO2+12e-+12H+=C2H4+4H2OΘ§Ι ¥πΑΗΈΣΘΚ2CO2+12e-+12H+=C2H4+4H2OΘΜ
Θ®3Θ©ΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§CO2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΗυΨίΆΦœώ÷Σ‘ΎΆΕΝœ±»œύΆ§ ±Θ§T1ΤΫΚβ ±CO2ΒΡΉΣΜ·¬ ¥σ”ΎT2Θ§‘ρT1![]() T2ΘΜ”…ΆΦΩ…÷ΣΘ§AΓΔCΈ¬Ε»œύΆ§Θ§Μ·―ßΤΫΚβ≥Θ ΐœύΆ§Θ§BΒψΈ¬Ε»ΗΏ”ΎAΓΔCΘ§KAΓΔKBΓΔKc»ΐ’Ώ¥σ–ΓΒΡΙΊœΒ «KA=KcΘΨKBΘ§Ι ¥πΑΗΈΣΘΚΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§CO2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΗυΨίΆΦœώ÷Σ‘ΎΆΕΝœ±»œύΆ§ ±Θ§T1ΤΫΚβ ±CO2ΒΡΉΣΜ·¬ ¥σ”ΎT2Θ§‘ρT1<T2ΘΜKA=KcΘΨKBΘΜ
T2ΘΜ”…ΆΦΩ…÷ΣΘ§AΓΔCΈ¬Ε»œύΆ§Θ§Μ·―ßΤΫΚβ≥Θ ΐœύΆ§Θ§BΒψΈ¬Ε»ΗΏ”ΎAΓΔCΘ§KAΓΔKBΓΔKc»ΐ’Ώ¥σ–ΓΒΡΙΊœΒ «KA=KcΘΨKBΘ§Ι ¥πΑΗΈΣΘΚΗΟΖ¥”ΠΒΡ’ΐΖ¥”ΠΈΣΖ≈»»Ζ¥”ΠΘ§…ΐΗΏΈ¬Ε»ΤΫΚβœρΡφΖ¥”ΠΖΫœρ“ΤΕ·Θ§CO2ΒΡΉΣΜ·¬ Φθ–ΓΘ§ΗυΨίΆΦœώ÷Σ‘ΎΆΕΝœ±»œύΆ§ ±Θ§T1ΤΫΚβ ±CO2ΒΡΉΣΜ·¬ ¥σ”ΎT2Θ§‘ρT1<T2ΘΜKA=KcΘΨKBΘΜ
Θ®4Θ©”…ΆΦΩ…÷ΣΘ§ΫΪ6molCO2ΚΆ12molH2≥δ»κ2LΒΡΟή±’»ίΤς÷–Θ§Ψ≠Ιΐ5minΖ¥”Π¥οΒΫΤΫΚβ ±Θ§CO2ΒΡΤΫΚβΉΣΜ·¬ ΈΣ60%Θ§”…ΧβΗχ ΐΨίΫ®ΝΔ»γœ¬»ΐΕΈ ΫΘΚ
2CO2Θ®gΘ©+6H2Θ®gΘ©![]() CH3OCH3Θ®gΘ©+3H2OΘ®gΘ©
CH3OCH3Θ®gΘ©+3H2OΘ®gΘ©
ΤπΘ®mol/LΘ© 3 6 0 0
±δΘ®mol/LΘ© 1.8 5.4 0.9 2.7
ΤΫΘ®mol/LΘ© 1.2 0.6 0.9 2.7
‘ρ0ΓΪ5minΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ Π‘(H2)= Γςc(H2)/ Γςt=5.4 mol/L/5min=1.08 mol/Θ®LΓΛminΘ©ΘΜΜ·―ßΤΫΚβ≥Θ ΐK=c(CH3OCH3)c3(H2O) /[c2(CO2)c6(H2)]=Θ®0.9ΓΝ2.73Θ©/Θ®1.22ΓΝ0.66Θ©Θ§Ι ¥πΑΗΈΣΘΚ1.08 mol/Θ®LΓΛminΘ©ΘΜΘ®0.9ΓΝ2.73Θ©/Θ®1.22ΓΝ0.66Θ©ΓΘ

ΓΨΧβΡΩΓΩ”ΑœλΜ·―ßΖ¥”ΠΥΌ¬ ΒΡ“ρΥΊΚήΕύΘ§Ρ≥–ΘΜ·―ß–ΓΉι”Ο Β―ιΒΡΖΫΖ®Ϋχ––ΧΫΨΩΓΘ Β―ι“©ΤΖΘΚΆ≠ΓΔΧζΓΔΟΨΓΔ0.5 mol L-1H2SO4»ή“ΚΓΔ2 mol L-1 H2SO4»ή“ΚΓΘΦΉΆ§―ß―–ΨΩΒΡ Β―ι±®Ηφ»γœ¬±μΓΟ
Β―ι≤Ϋ÷η | œ÷œσ | Ϋα¬έ |
ΔΌΖ÷±π»ΓΒ»ΧεΜΐΒΡ2 mol L-1 ΒΡΝρΥα»ή“Κ”Ύ»ΐ÷ß ‘Ιή÷– | Ζ¥”ΠΥΌ¬ ΓΟ ΟΨ>ΧζΘ§Ά≠≤ΜΖ¥”Π | Ϋπ τΒΡ–‘÷ ‘ΫΜνΤΟΘ§Ζ¥”ΠΥΌ¬ ‘ΫΩλ |
Θ®1Θ© ΦΉΆ§―ß±μ÷– Β―ι≤Ϋ÷ηΔΎΈΣ______________________ΓΘ
Θ®2Θ© ΦΉΆ§―ßΒΡ Β―ιΡΩΒΡ «__________________________ΓΘ
“ΣΒΟ≥ω’ΐ»ΖΒΡ Β―ιΫα¬έΘ§ΜΙ–η“ΣΩΊ÷ΤΒΡ Β―ιΧθΦΰ «_____________ΓΘ
““Ά§―ßΈΣΝΥΗϋΨΪ»ΖΒΊ―–ΨΩ≈®Ε»Ε‘Ζ¥”ΠΥΌ¬ ΒΡ”ΑœλΘ§άϊ”Ο»γΆΦΥυ ΨΉΑ÷ΟΫχ–– Β―ιΓΟ

Θ®3Θ©““Ά§―ß‘Ύ Β―ι÷–”ΠΗΟ≤βΕ®ΒΡ ΐΨί «_________________ΓΘ
Θ®4Θ©““Ά§―ßΆξ≥…ΗΟ Β―ι”Π―Γ”ΟΒΡ Β―ι“©ΤΖ «________________ΓΘ
ΓΨΧβΡΩΓΩΙΛ“Β÷Τ±ΗΒΣΜ·ΙηΒΡΖ¥”ΠΈΣΘΚ3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΠΛH<0Θ§ΫΪ0.3 molSiCl4 ΚΆ“ΜΕ®ΝΩ N2ΓΔH2 ΆΕ»κ2 LΖ¥”Π»ίΤςΘ§÷ΜΗΡ±δΈ¬Ε»ΧθΦΰ≤βΒΟSi3N4ΒΡ÷ ΝΩ±δΜ·»γœ¬±μΘΚ
Si3N4(s)+12HCl(g) ΠΛH<0Θ§ΫΪ0.3 molSiCl4 ΚΆ“ΜΕ®ΝΩ N2ΓΔH2 ΆΕ»κ2 LΖ¥”Π»ίΤςΘ§÷ΜΗΡ±δΈ¬Ε»ΧθΦΰ≤βΒΟSi3N4ΒΡ÷ ΝΩ±δΜ·»γœ¬±μΘΚ
±Φδ/min ÷ ΝΩ/g Έ¬ Ε»/Γφ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A. 250Γφ,«Α 2minΘ§ Si3N4 ΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ 0.02 molΓΛLΘ≠1ΓΛminΘ≠1
B. Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§ ΝΫ÷÷Έ¬Ε»œ¬ N2 ΚΆ H2 ΒΡΉΣΜ·¬ ÷°±»œύΆ§
C. ¥οΒΫΤΫΚβ«ΑΘ§ 300ΓφΧθΦΰΒΡΖ¥”ΠΥΌ¬ ±» 250ΓφΩλΘΜ ΤΫΚβΚσΘ§ 300Γφ±» 250Γφ¬ΐ
D. Ζ¥”Π¥οΒΫΤΫΚβ ±Θ§ ΝΫ÷÷ΧθΦΰœ¬Ζ¥”ΠΖ≈≥ωΒΡ»»ΝΩ“Μ―υΕύ



