题目内容
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| | 原子或分子相关信息 | 单质及其化合物相关信息 |
| X | ZX4分子是由粗Z提纯Z的中间产物 | X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z | Z原子的最外层电子数是次外层电子数的1/2 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W | W原子的最外层电子数小于4 | W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。
(1)第四周期 VIII族 4Fe(OH)2+O2+2H2O="=" 4Fe(OH)3
(2)  6H++Al2O3=2Al3++3H2O (3)光导纤维 SiO2+2C
6H++Al2O3=2Al3++3H2O (3)光导纤维 SiO2+2C Si+2CO↑ Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)360
Si+2CO↑ Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)360
解析试题分析:(1)根据题意可知:X是氯;Y是铝;Z是硅;W是铁。铁在所以周期表中位于第四周期第Ⅷ族。氢氧化亚铁在空气中被氧化的方程式是 4Fe(OH)2+O2+2H2O="=" 4Fe(OH)3(2)Cl-离子的结构示意图是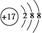 。氧化铝是两性氧化物,既能与强酸反应又能与强碱反应生成盐和水。高氯酸与氧化铝反应的离子方程式是:6H++Al2O3=2Al3++3H2O (3)SiO2广泛用作光导纤维。工业上制备单质硅的化学反应方程式是:SiO2+2C
。氧化铝是两性氧化物,既能与强酸反应又能与强碱反应生成盐和水。高氯酸与氧化铝反应的离子方程式是:6H++Al2O3=2Al3++3H2O (3)SiO2广泛用作光导纤维。工业上制备单质硅的化学反应方程式是:SiO2+2C Si+2CO↑ 锗在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)AlCl3+3NaOH=Al(OH)3↓+3NaCl。Al(OH)3++NaOH=NaAlO2+2H2O。n(AlCl3)=0.05mol,n(Al(OH)3)="m/M=1.56" g÷78g/mol=0.02mol.n(AlCl3)>n(Al(OH)3).沉淀没有达到最大值,一种情况是加入的氢氧化钠不足量,另一种情况是加入的氢氧化钠过量,溶解了一部分产生氢氧化铝沉淀。加入NaOH溶液的体积最多时是第二种情况n(NaOH)=4n(AlCl3)-n(Al(OH)3)=4×0.05mol-0.02mol=0.18mol.所以氢氧化钠的体积是V="n/C=0.18mol÷0.5" mol·L-1=0.36L=360ml.
Si+2CO↑ 锗在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为Ge+2 H2O2+2NaOH=Na2GeO3+3H2O (4)AlCl3+3NaOH=Al(OH)3↓+3NaCl。Al(OH)3++NaOH=NaAlO2+2H2O。n(AlCl3)=0.05mol,n(Al(OH)3)="m/M=1.56" g÷78g/mol=0.02mol.n(AlCl3)>n(Al(OH)3).沉淀没有达到最大值,一种情况是加入的氢氧化钠不足量,另一种情况是加入的氢氧化钠过量,溶解了一部分产生氢氧化铝沉淀。加入NaOH溶液的体积最多时是第二种情况n(NaOH)=4n(AlCl3)-n(Al(OH)3)=4×0.05mol-0.02mol=0.18mol.所以氢氧化钠的体积是V="n/C=0.18mol÷0.5" mol·L-1=0.36L=360ml.
考点:考查元素的推断及氧化铝、氢氧化铝的两性等知识。

X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
| A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1 |
| B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1 |
| C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1 |
| D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1 |
 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第 周期第 族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的 (填“大”或“小”),X的单质分子中σ键和π键的数目比为 ,Y氧化物属于 晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式 。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s) △H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s) △H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是 。