题目内容
A、B、C、D、E五种短周期元素,原子序数依次增大,有关信息如下。
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质既可与盐酸反应,又可与NaOH溶液反应 |
| E | 原子最外层电子数比次外层电子数少1个 |
请回答下列问题:
(1)A的氢化物的水溶液能使酚酞试液变红,原因是(用电离方程式表示),实验室制取该氢化物的化学方程式是 。
(2)A与B可组成质量比为7∶16的三原子分子,下列环境问题与该物质的排放有关的是(填序号)。
①酸雨 ②温室效应 ③臭氧层破坏 ④光化学污染
(3)C的最高价氧化物的水化物与E单质反应可用于生产消毒液,其离子方程式是 。
(4)D在元素周期表中的位置是。由元素A、D组成某化合物,具有良好电绝缘性,该物质与水缓慢反应的化学方程式是 。
(1)NH3·H2O NH4++OH-(1分)
NH4++OH-(1分)
2NH4Cl+Ca(OH)2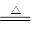 CaCl2+2NH3↑+2H2O(1分)
CaCl2+2NH3↑+2H2O(1分)
(2)①④(2分,选对1个得1分,有错不得分)
(3)Cl2+2OH-=Cl-+ClO-+H2O(1分)
(4)第3周期ⅢA族(1分)
AlN+3H2O=Al(OH)3↓+NH3↑(2分)
解析试题分析:最高价氧化物对应的水化物与其氢化物反应生成离子化合物说明是硝酸铵,A为氮元素;地壳中含量最多的元素是氧,则B为氧元素。C单质须保存在煤油中可知是钠元素。D单质既可与盐酸反应,又可与NaOH溶液反应可知是铝元素。E原子最外层电子数比次外层电子数少1个,是氯元素。(1)A的氢化物的水溶液能使酚酞试液变红,原因是NH3·H2O NH4++OH-;实验室制取该氢化物的化学方程式是2NH4Cl+Ca(OH)2
NH4++OH-;实验室制取该氢化物的化学方程式是2NH4Cl+Ca(OH)2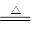 CaCl2+2NH3↑+2H2O。(2)A与B可组成质量比为7∶16的三原子分子是二氧化氮,可以产生①酸雨;④光化学污染。(3)生产消毒液,其离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。(4)D在元素周期表中的位置是第3周期ⅢA族;由元素A、D组成某化合物AlN,与水缓慢反应的化学方程式是AlN+3H2O=Al(OH)3↓+NH3↑。
CaCl2+2NH3↑+2H2O。(2)A与B可组成质量比为7∶16的三原子分子是二氧化氮,可以产生①酸雨;④光化学污染。(3)生产消毒液,其离子方程式是Cl2+2OH-=Cl-+ClO-+H2O。(4)D在元素周期表中的位置是第3周期ⅢA族;由元素A、D组成某化合物AlN,与水缓慢反应的化学方程式是AlN+3H2O=Al(OH)3↓+NH3↑。
考点:考查本题考查了元素位置结构及其相互关系的应用,正确推断元素是解本题关键。

A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 雷雨天大气中会有A的一种单质生成 |
| B | B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小Ks5u |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为 , 。
(2)F的氢化物是由 (极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式 。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为 , (写化学式)。
②溶液a与固体a反应的离子方程式为 。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因 。
一定温度范围内用氯化钠熔浸钾长石(主要成份为KAlSi3O8)可制得氯化钾,主要反应是:NaCl(l)+KAlSi3O8(s) KCl(l)+NaAlSi3O8(s)。
KCl(l)+NaAlSi3O8(s)。
(1)氯化钠的电子式是 。
(2)上述反应涉及的元素中,原子半径最大的是 。
(3)上述反应涉及的位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最价氧化物的水化物均能发生反应,该元素是 。
(4)某兴趣小组为研究上述反应中钾元素的熔出率(液体中钾元素的质量占样品质量的百分率)与温度的关系,进行实验(保持其它条件不变),获得如下数据:
| 时间(h) 熔出率 温度 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 | 5.0 |
| 800℃ | 0.054 | 0.091 | 0.127 | 0.149 | 0.165 | 0.183 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 | 0.687 |
| 860℃ | 0.515 | 0.624 | 0.671 | 0.690 | 0.689 | 0.690 |
| 950℃ | 0.669 | 0.714 | 0.710 | 0.714 | 0.714 | ―― |
①分析数据可以得出,氯化钠熔浸钾长石是 (填“放热”或“吸热”)反应。
②950℃时,欲提高熔出钾的速率可以采取的措施是 (填序号)。
a.充分搅拌
b.延长反应时间
c.增大反应体系的压强
d.将钾长石粉粹成更小的颗粒
(5)该方法制得KCl提纯后可用来冶炼金属钾。反应Na(l)+KCl(l)
 NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。
NaCl(l)+K(g)是工业上冶炼金属钾常用的方法,用平衡原理解释该方法可行的原因是 。