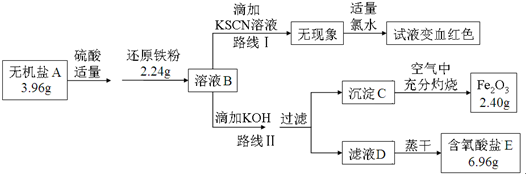
题目内容
3.常温下,下列表述正确的是( )| A. | pH=2的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 | |
| B. | 向NaHC03溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO-)增 大 | |
| C. | Na2C03溶液中:即c(Na+)>C(CO32-)>C(OH-)=C(HCO3-)>C(H+) | |
| D. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-) |
分析 A、醋酸是弱电解质而盐酸是强电解质完全电离,所以氢离子浓度相同的两溶液醋酸的浓度大;
B、向NaHC03溶液中加入少量NaOH固体,以促进碳酸氢根离子的电离;
C、应考虑碳酸氢根离子继续水解生成氢氧根离子并且水电离产生氢氧根离子;
D、电荷守恒分析解答.
解答 解:A、醋酸是弱电解质而盐酸是强电解质完全电离,所以氢离子浓度相同的两溶液醋酸的浓度大,故A错误;
B、向NaHC03溶液中加入少量NaOH固体,以促进碳酸氢根离子的电离,所以c(HCO-)减小,故B错误;
C、应考虑碳酸氢根离子继续水解生成氢氧根离子并且水电离产生氢氧根离子,所以离子浓度大小为:c(Na+)>C(CO32-)>C(OH-)>C(HCO3-)>C(H+),故C错误;
D、电荷守恒可知:混合溶液均存在:C(Na+)+c(H+)=C(CH3COO-)+C(OH-),故D正确;
故选D.
点评 本题考查离子浓度的大小,学生要学会影响盐的水解平衡移动的因素以及离子浓度大小比较的方法等知识,难度不大.

练习册系列答案
相关题目
17.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
11.下列实验操作与预期实验目的或所得实验结论都正确的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 向某有机物中加入新制Cu(OH)2悬浊液并加热,有砖红色沉淀 | 该有机物一定是醛 |
| B | 将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,未产生浅黄色沉淀 | 证明CH3CH2Br未发生水解 |
| C | 分别给乙醇和苯酚溶液中加入紫色石蕊试液,观察其颜色的变化 | 比较乙醇和苯酚的酸性强弱 |
| D | 用pH试纸测定CH3COONa溶液的pH | 证明CH3COOH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
8.用NA表示阿伏加德罗常数.下列说法中,正确的是( )
| A. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| B. | 2.0g重水(2H2O)中含有的质子数为1.0 NA | |
| C. | 标准状况下,11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为NA | |
| D. | 标准状况下,2.24LSO3中含有的O原子的数目为0.3NA |
15. 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
①20min时,υ正(CO2 )>80min时υ逆(H2O)(填“>”、“=”或“<”).
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:Ⅰ.N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
Ⅱ.2N2(g)+6H2O(l)?4NH3(g)+3O2(g)△H=+1530.0kJ/mol
(1)根据上述反应,写出表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)?H2O(l)△H=-285.8kJ/mol.
(2)2NH3(g)?N2(g)+3H2(g)在恒容密闭容器中达到平衡的标志有:C.
①单位时间内生成3n mol H2同时生成2n mol NH3
②用NH3、N2、H2表示反应速率比为2:1:3
③混合气体的密度不再改变
④混合气体压强不再改变
⑤混合气体平均相对分子质量不再改变
A.①③④B.①②④⑤C.①④⑤D.②③④
(3)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)$\stackrel{一定条件}{?}$CO(NH2)2(1)+H2O△H<0
t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3,重新建立平衡后CO2的转化率与原平衡相比将增大(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为76.53(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象.保持其它条件不变,则(t+10)℃下正确的图象可能是B(填图甲中的“A”或“B”).
12.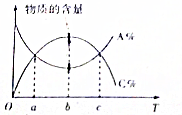 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
 对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )
对于反应mA+nB?pC,在其它条件不变时,A与C两物质的物质的量随温度的变化情况如图所示,则下列说法正确的是( )| A. | 该反应为吸热反应 | |
| B. | 在a,c时刻,正逆反应速率相等 | |
| C. | 若横轴为压强,则存在m+n<p | |
| D. | b时刻正逆反应速率大于c时刻的正逆反应速率 |
13.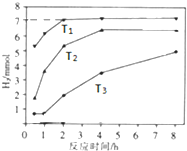 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )| A. | 反应的平均速率v(A)=0.04 mol/(L•min) | |
| B. | 达平衡时A、B的转化率相等 | |
| C. | 向平衡混合物中再加入0.1 mol A、0.2 mol B,达新平衡时C的体积分数减小 | |
| D. | 若升高温度达新平衡后,A的浓度增大,则△H>0 |