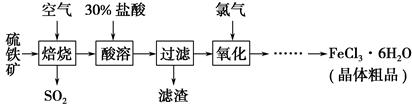
��Ŀ����
��ͼ�ǵ�Ԫ�صļ��ּ�̬���������Ķ�Ӧ��ϵ��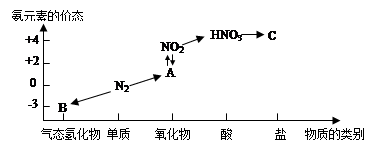
�ش��������⣺
��1��д��N2��һ����; ��
��2����NԪ�ػ��ϼ۷�����N2���������Ժͻ�ԭ�ԡ�����һ��˵�����û�ѧ����ʽ��ʾ��
�������� ��
��ԭ�� ��
��3��HNO3����ͼ�е�����C�����ڼ���Cl-�Ĵ��ڣ���C�Ļ�ѧʽΪ________��
��4��ʵ������ȡ����B�Ļ�ѧ����ʽΪ ��
��5��NO2��ˮ��Ӧ��������A�Ļ�ѧ����ʽΪ ��
��6��Ũ������ľ̿�ڼ��������·�Ӧ�Ļ�ѧ����ʽΪ ��
��1������������������ʳ���ư����ȡ�
��2��N2+3H2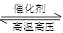 2NH3�� N2+O2
2NH3�� N2+O2 2NO��N2+3Mg
2NO��N2+3Mg Mg3N2��
Mg3N2��
��3��AgNO3
��4��Ca(OH)2+2NH4Cl CaCl2+2NH3��+2H2O
CaCl2+2NH3��+2H2O
��5��3NO2+H2O��2HNO3+NO
��6��4HNO3(Ũ)+C CO2��+4NO2��+2H2O
CO2��+4NO2��+2H2O
���������������1�����ڵ�����ѧ���ʲ����ã���������������������ʳ���ư����ȡ���2��N2�õ����ӣ����ϼ۽��ͣ����������ԣ�N2+3H2 2NH3��N2ʧȥ���ӣ����ϼ����ߣ����ֻ�ԭ�ԣ�N2+O2
2NH3��N2ʧȥ���ӣ����ϼ����ߣ����ֻ�ԭ�ԣ�N2+O2 2NO��N2+3Mg
2NO��N2+3Mg Mg3N2����3��Cl-�ļ��鷽�����������Һ�м��������ữ���ٵμ�AgNO3��Һ�����������dz�������֤����Һ�к���Cl-�����CΪAgNO3����4����ʵ���������������������ȡ�����ġ���ȡ���ʰ����Ļ�ѧ����ʽΪCa(OH)2+2NH4Cl
Mg3N2����3��Cl-�ļ��鷽�����������Һ�м��������ữ���ٵμ�AgNO3��Һ�����������dz�������֤����Һ�к���Cl-�����CΪAgNO3����4����ʵ���������������������ȡ�����ġ���ȡ���ʰ����Ļ�ѧ����ʽΪCa(OH)2+2NH4Cl CaCl2+2NH3��+2H2O����5��NO2��ˮ��Ӧ��������NO�Ļ�ѧ����ʽΪ3NO2+H2O��2HNO3+NO����6��Ũ������ǿ�����ԣ��ڼ�����������ľ̿������Ӧ����CO2��NO2��H2O����Ӧ�Ļ�ѧ����ʽΪ4HNO3(Ũ)+C
CaCl2+2NH3��+2H2O����5��NO2��ˮ��Ӧ��������NO�Ļ�ѧ����ʽΪ3NO2+H2O��2HNO3+NO����6��Ũ������ǿ�����ԣ��ڼ�����������ľ̿������Ӧ����CO2��NO2��H2O����Ӧ�Ļ�ѧ����ʽΪ4HNO3(Ũ)+C CO2��+4NO2��+2H2O��
CO2��+4NO2��+2H2O��
���㣺���鰱����ʵ�����Ʒ���Cl-�ļ��顢����Ԫ�صĵ��ʼ�����������ʵĻ�ѧ����ʽ��ʾ��֪ʶ��

ʵ������ͭ�Ʊ�CuSO4��Һ�ж��ַ�����ijʵ��С��������������ַ�����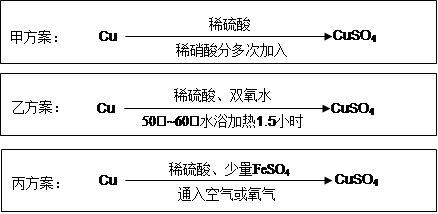
��ش��й����⣺
��1��������
��д���÷�Ӧ�����ӷ���ʽ ��
��Ϊ�˽�Լԭ�ϣ��������������ʵ���֮�����Ϊ��n(H2SO4)��n(HNO3)= ��
��2���ҷ�������6.4gͭ˿�ŵ�90mL 1.5mol��L-1��ϡ�����У�������50�档����40mL 10%��H2O2����Ӧ0.5Сʱ�����µ�60�棬������Ӧ1Сʱ��һϵ�в�������CuSO4��5H2O 20.0g����֪�й�Ħ���� ����M(Cu)=64g/mol�� M(CuSO4��5H2O) =250g/mol����
�ٷ�Ӧʱ�¶ȿ�����50��~60�棬���˹��ߵ�ԭ���� ��
�ڱ�ʵ��CuSO4��5H2O�IJ���Ϊ ��
��3����������������������ֱ��ͨ�뵽ͭ����ϡ����Ļ�����У������ڳ����¼�������Ӧ����ӦҺ�м�����FeSO4����������Ӧ����������ͭ����Ӧ��ȫ������A����pH��4 ��Ȼ����ˡ�Ũ�����ᾧ��
������A��ѡ�����µ� ������ţ���
| A��CaO | B��NaOH | C��CuCO3 | D��Cu2(OH)2CO3 E��Fe2(SO4)3 |
��4���Աȼס��ҡ�������ʵ�鷽�������������ŵ��У�д��������
�� ��







 2ClO2��+2Na2SO4��H2O
2ClO2��+2Na2SO4��H2O H++OH-�� ________________�������ӷ���ʽ��ʾ��.
H++OH-�� ________________�������ӷ���ʽ��ʾ��.