题目内容
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。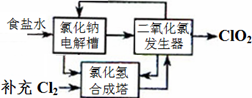
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4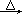 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)
(1)H2、Cl2 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)同时产生了大量的氯气,不仅产率低,而且产品难以分离,同时很有可能造成环境污染;能耗较大等
(3)1C6H12O6+24NaClO3+12H2SO4→24ClO2↑+6CO2↑+18H2O+12Na2SO4, 0.16NA,
(4)2.5
(5)SO32- +H2O OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O OH-+H2SO3;Na+ SO32- OH- HSO3- H +
OH-+H2SO3;Na+ SO32- OH- HSO3- H +
(6)NaHSO3、Na2SO3、 NaCl、或(NaHSO3、Na2SO3、 NaCl、SO2、H2SO3)
解析试题分析:
(1)有工艺流程图可以看出:在该工艺中可利用的单质有H2、Cl2 。根据流程图、质量守恒定律及电子守恒规律可得出在发生器中生成ClO2的化学方程式为: 2NaClO3+ 4HCl=2ClO2↑+Cl2↑+ 2NaCl + 2H2O
(2)由 制备原理和流程图可知此法的缺点主要是会产生大量的Cl2,消耗大量的电能,产物ClO2和Cl2不仅不容易分离,而且物质利用率低,很容易造成大气污染。
(3)纤维素水解得到的最终产物X是葡萄糖C6H12O6。它与NaClO3在酸性条件下发生反应,根据质量守恒定律和电子守恒的知识可得方程式为1C6H12O6+24NaClO3+12H2SO 4→24ClO2↑+6CO2↑ +18H2O+ 12Na2SO4,由方程式可以看出每产生30mol的气体,转移电子24NA。现在产生气体颚物质的量为4.48L ÷22.4L/mol=0.2mol。所以转移电子的物质的量为24NA÷30×0.2="0.16" NA
(4)处理含CN—相同量的电镀废水,即转移电子的物质的量相同。假设转移电子2mol,则需要Cl2的物质的量是1mol;需要ClO2的物质的量为2÷=0.4mol。所以n(Cl2): n(ClO2)=1:0.4=2.5。
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O
H++OH-和SO32-的水解平衡的两种方程式。由于SO32-是二元弱酸的酸根离子,因此存在两步水解平衡SO32- +H2O  OH-+HSO3-, HSO3- +H2O
OH-+HSO3-, HSO3- +H2O  OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
OH-+H2SO3。Na2SO3=2Na++ SO32-;c(Na+)>c(SO32-).SO32-水解产生OH-和HSO3-,HSO3-进一步水解还要消耗HSO3-,同时产生OH-,因此c(OH-)>c(HSO3-).在溶液中还存在水的电量平衡,所以c(HSO3-)>c(H+).在溶液中盐水解的程度是很微弱的,所以c(SO32-)> c(OH-)。因此在该溶液中各种离子的浓度由大到小的顺序为c(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)。
(6)在Na2SO3溶液中滴加稀盐酸若恰好发生反应:Na2SO3+HCl=NaCl+NaHSO3。则由于NaHSO3溶液呈酸性。所以至中性时,n(HCl)<n(Na2SO3).产生溶液中含有的溶质有未反应的Na2SO3及反应生成的NaCl、NaHSO3。溶质有Na2SO3、NaCl、NaHSO3。也可能滴加HCl局部过量会产生SO2、H2SO3溶解在该溶液中还含有SO2和H2SO3。
考点:考查物质的制备、化学方程式的书写、电子的转移、溶液中的化学平衡、离子浓度的大小比较。

 名校课堂系列答案
名校课堂系列答案某校化学研究性学习小组,在学习金属的冶炼以后对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后发现,一氧化碳的制备可利用甲酸和浓硫酸共热到60~80 ℃发生脱水反应制取:
HCOOH CO↑+H2O
CO↑+H2O
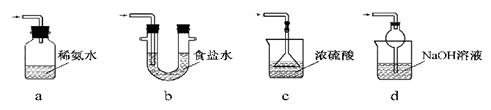
请根据以下各图帮他们组装成一套相对合理的实验装置图(某些装置可重复使用)。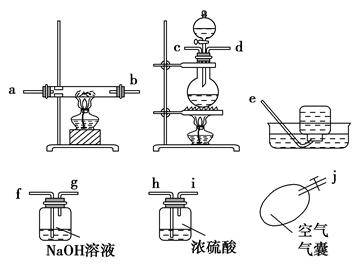
回答以下问题:
(1)合理实验装置的连接顺序是(写小写字母) 。
(2)在反应时一定要先通一会一氧化碳气体,然后再点燃加热氧化铁的酒精灯,原因是 。
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
(4)在观察到硬质玻璃管中的物质由 色完全变为 色时停止加热,然后继续 ,原因是防止铁被氧化。
(5)硬质玻璃管中发生反应的化学方程式为 。
(6)该实验的一个优点是把实验过程中的尾气利用排水法收集起来,收集的气体前后有几瓶,分别按收集的先后顺序编号,点燃各个瓶中的气体,中间编号的集气瓶中气体 ,编号最先和最后的集气瓶中气体 ,原因是 。
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
| 步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
| 步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
___________________________________________________________。

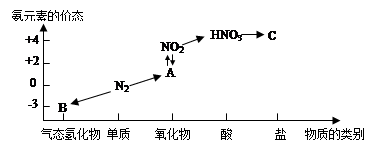
 C
C