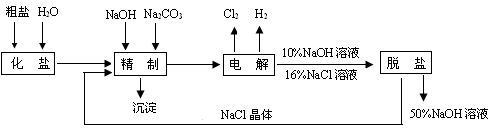
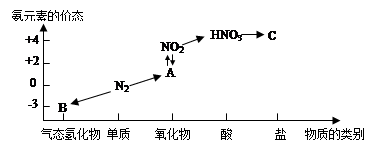题目内容
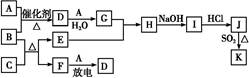
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式 。
(2)定出反应①②的化学方程式:
① ,
② 。
(3)写出反应③的离子方程式: 。
(4)J与F反应的化学方程式: 。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为 mol。
(1)NH4HCO3
(2)①2Mg+CO2  2MgO+C
2MgO+C
②4NH3+5O2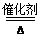 4NO+6H2O
4NO+6H2O
(3)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
(4)C+4HNO3(浓)  CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
(5)0.2
解析

某校化学研究性学习小组,在学习金属的冶炼以后对一氧化碳还原金属氧化物的实验非常感兴趣,他们查阅有关资料后发现,一氧化碳的制备可利用甲酸和浓硫酸共热到60~80 ℃发生脱水反应制取:
HCOOH CO↑+H2O
CO↑+H2O
请根据以下各图帮他们组装成一套相对合理的实验装置图(某些装置可重复使用)。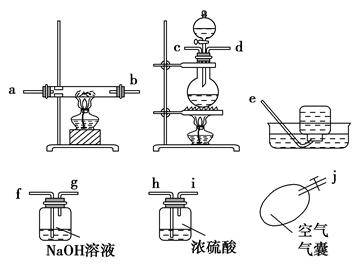
回答以下问题:
(1)合理实验装置的连接顺序是(写小写字母) 。
(2)在反应时一定要先通一会一氧化碳气体,然后再点燃加热氧化铁的酒精灯,原因是 。
| A.因为一般反应从左到右进行 |
| B.排除体系内的空气,使反应过程更安全 |
| C.甲酸与浓硫酸反应可以产生大量的CO |
| D.此反应加热时间长有利于产生CO |
(4)在观察到硬质玻璃管中的物质由 色完全变为 色时停止加热,然后继续 ,原因是防止铁被氧化。
(5)硬质玻璃管中发生反应的化学方程式为 。
(6)该实验的一个优点是把实验过程中的尾气利用排水法收集起来,收集的气体前后有几瓶,分别按收集的先后顺序编号,点燃各个瓶中的气体,中间编号的集气瓶中气体 ,编号最先和最后的集气瓶中气体 ,原因是 。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
| 步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
| 步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。