题目内容
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: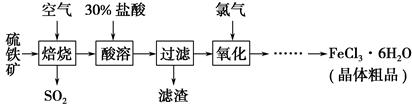
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g)??2SO3(g),该反应的平衡常数表达式为K=________;过量的SO2与NaOH溶液反应的化学方程式为
_____________________________________________________________。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是________、________。
(3)通氯气氧化时,发生的主要反应的离子方程式为____________;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为________(写化学式)。
(1)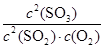 SO2+NaOH=NaHSO3
SO2+NaOH=NaHSO3
(2)提高铁元素的浸出率 抑制Fe3+水解
(3)Cl2+2Fe2+=2Cl-+2Fe3+ Cl2、HCl
解析

硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
| 步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
| 步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
“蛇纹石石棉”主要成分有二氧化硅、氧化镁和结晶水,它的化学式是Mg6[(OH)4Si2O5]2。
(1)“蛇纹石石棉”的氧化物形式为______________________,其中原子半径最大的元素
在周期表中的位置是______________________。
(2)Si原子的最外层的电子排布式为_____________,SiO2与NaOH溶液反应的化学方程式
为________________________________________________。
(3) SiCl4比SiO2的熔点_____(填“低”、“高”),原因是__________________________。
(4)从哪些方面不能判断Si和O的非金属性强弱 。
| A.利用Si和O在周期表中的位置 |
| B.SiO2与水不发生反应 |
| C.Si在一定条件下与氧气反应,生成SiO2 |
| D.H2SiO3的酸性比H2O的酸性强 |
 H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。

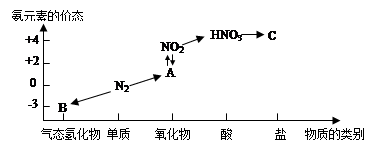
 C
C