题目内容
10. (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成表格.△H=-56.8kJ/mol
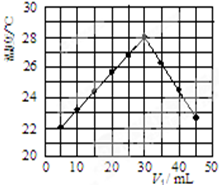
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃,此反应所用NaOH溶液的浓度应为1.5mol/L.
(二)通过化学计算间接获得
(1)已知拆开1mol的H-H键、I-I、H-I键分别需要吸收的能量为436kJ、153kJ、299kJ.则反应H2(g)+I2(g)=2HI(g)的反应热△H=-9 kJ•mol-1
(2)已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
根据上述反应确定:H2燃烧热为285.8kJ•mol-1.
分析 (一)(1)根据量热计的构造和实验步骤选用需要的仪器来判断尚缺少的实验玻璃用品;
(2)先先判断温度差的有效性,然后求出温度差平均值,再根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(3)实验时的温度应为酸碱未混合之前的温度;恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL,以此计算NaOH浓度;
(二)(1)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应,据此计算反应热;
(2)燃烧热是1mo可燃物完全燃烧生成稳定氧化物放出的热量,液态水为稳定的氧化物;
解答 解:(一)(1)中和热测定的实验装置如图 ,需要温度计测定温度、环形玻璃搅拌棒搅拌使溶液混合均匀,还需要量筒量取一定量的酸、碱溶液,由题目提供的实验用品可知,尚缺少的实验玻璃用品是量筒、温度计,
,需要温度计测定温度、环形玻璃搅拌棒搅拌使溶液混合均匀,还需要量筒量取一定量的酸、碱溶液,由题目提供的实验用品可知,尚缺少的实验玻璃用品是量筒、温度计,
故答案为:量筒、温度计;
(2)2次温度差分别为:3.3℃,3.5℃,2组数据都有效,温度差平均值=3.4℃,50mL0.55mol•L-1NaOH
和50mL.0.5mol•L-1HCl质量和为m=100mL×1g/mL=100g,c=4.18J/(g•℃),△T=3.4℃,代入公式Q=cm△T得生成0.025mol的水放出热量Q=4.18J/(g•℃)×100g×3.4℃=1421.2J=1.4212KJ,即生成0.025mol的水放出热量1.4212KJ,所以生成1mol的水放出热量为$\frac{1.4212KJ×1mol}{0.025mol}$=56.8kJ,即该实验测得的中和热△H=-56.8kJ/mol,
故答案为:-56.8kJ/mol;
(3)温度为22℃时加入盐酸5mL,则不是实验温度,酸碱中和为放热反应,所以研究小组做该实验时环境温度低于22℃,
酸碱中和恰好反应时参加反应的盐酸溶液的体积是30mL,由V1+V2=50Ml可知,消耗的氢氧化钠溶液的体积为20mL,恰好反应时氢氧化钠溶液中溶质的物质的量是n,由HCl+NaOH=NaCl+H2O可知,n=1.0mol•L-1×0.03L=0.03mol,所以浓度c=$\frac{0.03mol}{0.02L}$=1.5mol/L,
故答案为:低于;1.5;
(二)(1)氢气和碘反应生成2molHI是,旧键断裂吸收能量的值为:436kJ+153kJ=589KJ,新键生成释放能量为:299kJ×2=598KJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,放出的热量为:598KJ-589KJ=9KJ,
故答案为:-9;
(2)根据燃烧热概念,结合热化学方程式,2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ/mol,氢气的燃烧热为:H2(g)+$\frac{1}{2}$O2(g)=H2O (l)△H=-285.8kJ/mol,所以氢气的燃烧热为285.8KJ/mol,
故答案为:285.8;
点评 本题考查中和热的测定、中和热的计算、燃烧热的判断等知识,题目难度不大,注意理解中和热的概念以及热量计算公式的应用中热量单位的换算.

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | 标准状况下,22.4L苯含有NA个苯分子 | |
| B. | 0.2 mol•L-1 FeCl3溶液中含有Cl-总数为0.6NA | |
| C. | 在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 | |
| D. | 4g氦气所含分子数为NA |
| A. | 0.1 mol•L-1Ca(NO3)2溶液中:Na+、N${{H}_{4}}^{+}$、C${{O}_{3}}^{2-}$、CH3COO- | |
| B. | 能使甲基橙变红的溶液中:K+、Na+、N${{O}_{3}}^{-}$、Cl- | |
| C. | 3%H2O2溶液中:Fe2+、H+、S${{O}_{4}}^{2-}$、Cl- | |
| D. | 0.1 mol•L-1KSCN溶液中:Fe3+、N${{H}_{4}}^{+}$、Br-、S${{O}_{4}}^{2-}$ |
C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
H2O(g)═H2O(l)△H3=-c kJ/mol
若使92g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A. | 4a+4b+4c | B. | 2a-2b+6c | C. | 2a-2b+2c | D. | 2a-6b+2c |
| A. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| B. | 常温下,1L 0.1mol/LNa2S溶液中,含有S2-数为0.1NA | |
| C. | 7.8 g过氧化钠与足量二氧化碳反应转移的电子数为0.1NA | |
| D. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为6NA |
| A. | 澄清的石灰水,浓硫酸 | B. | 浓硫酸,溴水 | ||
| C. | 溴水,浓硫酸 | D. | 浓硫酸,酸性KMnO4溶液 |
 ,F的电子式为
,F的电子式为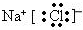 .
.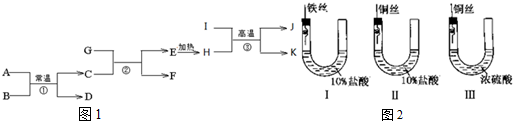
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题: