题目内容
5.已知:C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/molC2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
H2O(g)═H2O(l)△H3=-c kJ/mol
若使92g酒精液体完全燃烧,最后恢复到室温,则放出的热量(单位kJ)为( )
| A. | 4a+4b+4c | B. | 2a-2b+6c | C. | 2a-2b+2c | D. | 2a-6b+2c |
分析 92g液态酒精的物质的量为$\frac{92g}{46g/mol}$=2mol,根据盖斯定律构造出目标热化学反应方程式,
①C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/mol
②C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
③H2O(g)═H2O(l)△H3=-c kJ/mol
[①-②+③×3]得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)反应热与化学计量数成正比,据此计算判断.
解答 解:已知:①C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H1=-a kJ/mol
②C2H5OH(g)═C2H5OH(l)△H2=-b kJ/mol
③H2O(g)═H2O(l)△H3=-c kJ/mol
由盖斯定律[①-②+③×3]得:C2 H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)则△H=-(a-b+3c)kJ•mol-1,
92g液态酒精的物质的量为$\frac{92g}{46g/mol}$=2mol,完全燃烧,最后恢复到室温,反应热与化学计量数成正比,则放出的热量(单位kJ)为2a-2b+6c,
故选B.
点评 本题考查根据盖斯定律计算反应热,题目难度不大,关键是构造目标热化学反应方程式,注意反应热的符号.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数均与其电子层数相等.Y能分别与X、Z形成原子个数比为1:3的共价化合物,常温下YX3是一种刺激性气味的气体.下列说法正确的是( )
| A. | 原子半径:Z<Y<W,而离子半径:W<Y<Z | |
| B. | 含W的盐溶液一定呈酸性 | |
| C. | 由X、Y、Z组成的盐的水溶液呈酸性,则溶液中该盐阳离子浓度大于酸根离子浓度 | |
| D. | W和Y形成的原子个数比为1:1的共价化合物,具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域,是一种原子晶体 |
16.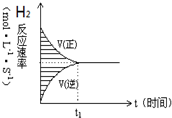 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
 14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )
14、一定条件下,VL的密闭容器中充入2molH2(气)和2mol I2(气),发生反应:H2(气)+I2(气)?2HI(气),实验过程中的速率与时间的变化关系如图所示.下列说法正确的是( )| A. | 阴影部分面积表示H2物质的量浓度的减少 | |
| B. | 反应达到限度时,H2、I2、HI的物质的量浓度比一定为1:1:2 | |
| C. | 当容器中密度保持不变时,说明反应一定达到平衡状态 | |
| D. | 若0~10s内,HI的平均速率为0.01mol/(L•s),10s时H2余1.9mol,则容器体积V为2L |
10. (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
(2)他们记录的实验数据如下:
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成表格.△H=-56.8kJ/mol
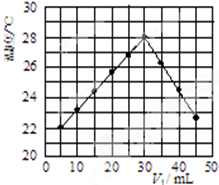
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃,此反应所用NaOH溶液的浓度应为1.5mol/L.
(二)通过化学计算间接获得
(1)已知拆开1mol的H-H键、I-I、H-I键分别需要吸收的能量为436kJ、153kJ、299kJ.则反应H2(g)+I2(g)=2HI(g)的反应热△H=-9 kJ•mol-1
(2)已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
根据上述反应确定:H2燃烧热为285.8kJ•mol-1.
 (一)实验方法测定反应热---------中和热测定
(一)实验方法测定反应热---------中和热测定(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃棒、0.5mol•L-1 盐酸、0.55mol•L-1NaOH溶液,尚缺少的实验玻璃用品是量筒、温度计.
| 实 验 用 品 | 溶 液 温 度 | 中和热△H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1Cl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知:Q=Cm(t2-t1),反应后溶液的比热容C为4.18KJ•℃-1•Kg-1,各物质的密度均为1g•cm-3.计算完成表格.△H=-56.8kJ/mol
(3)某研究小组将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:
研究小组做该实验时环境温度低于(填“高于”、“低于”或“等于”)22℃,此反应所用NaOH溶液的浓度应为1.5mol/L.
(二)通过化学计算间接获得
(1)已知拆开1mol的H-H键、I-I、H-I键分别需要吸收的能量为436kJ、153kJ、299kJ.则反应H2(g)+I2(g)=2HI(g)的反应热△H=-9 kJ•mol-1
(2)已知:2H2(g)+O2(g)=2H2O (l)△H=-571.6kJ•mol-1H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ•mol-1
根据上述反应确定:H2燃烧热为285.8kJ•mol-1.
17.下列说法正确的是( )
| A. | 煤的干馏是物理变化 | |
| B. | 石油裂解的目的主要是为了得到更多的汽油 | |
| C. | 石油分馏能得到不同沸点范围的产物 | |
| D. | 石油裂化主得到的是乙烯、丙烯等 |
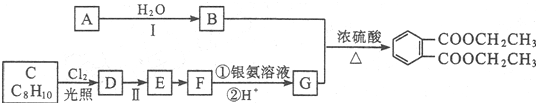
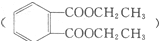 路线:
路线: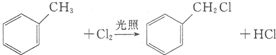
 .
.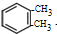 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$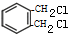 +2HCl
+2HCl