题目内容
难挥发性二硫化担(TaS2)可采用如下装置提纯。将不纯的TaS2粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下:

下列说法正确的是

下列说法正确的是
| A.该反应的△H>0 |
| B.在提纯过程中,S2的量不断增加 |
| C.该反应的平衡常数与I2的浓度成正比 |
| D.经过足够长时间后,石英管右端将得到纯净的TaS2 |
C
试题分析:依题意,高温区不纯的TaS2(s)与I2(g)发生反应生成TaI4(g)和S2(g),低温区TaI4(g)和S2(g)发生反应生成TaS2(s)与I2(g),而杂质则留在高温区,说明升高温度平衡向正反应方向移动,由于升高温度平衡向吸热方向移动,则正反应是吸热反应,正反应的△H>0,故A正确;高温区生成S2(g)的物质的量等于低温区消耗S2(g)的物质的量,所以S2(g)的量不会改变,只能高温区生成的S2(g)比消耗的S2(g)多,低温区消耗的S2(g)比生成的S2(g)多,故B错误;固体物质不能写入平衡常数表达式,则该反应的平衡常数等于平衡时TaI4(g)和S2(g)的物质的量浓度幂之积与I2(g)的物质的量浓度的2次方的比值,即平衡常数与平衡时I2(g)的物质的量浓度成反比例,故C错误;经过足够长的时间,石英管右端将得到熔沸点较高的杂质,左端将得到纯净的、熔沸点较低的TaS2(s),故D错误。

练习册系列答案
相关题目
 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: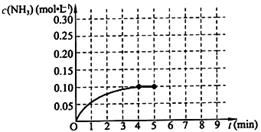
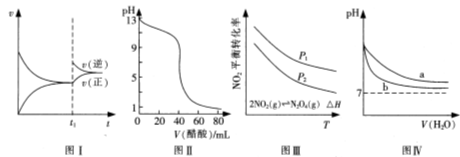
 2NH3的速率时间图像,t1时刻改变的条件是升高温度
2NH3的速率时间图像,t1时刻改变的条件是升高温度 H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为
H2+CO2。向容器内加入1molCO和1mol H2O(g)时,生成2/3mol CO2如果通入的H2O(g)改为4mol时,在上述条件下,生成CO2的物质的量为 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表: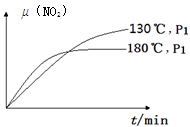
 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。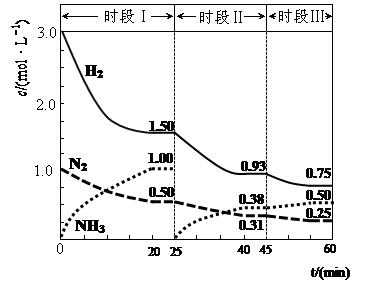
 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
 Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3
Ni(s)+4CO(g)的平衡常数为0.5(mol·L-1)3 3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g) + D(s),反应达到平衡时C的浓度为1.2 mol/L.