题目内容
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
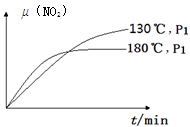
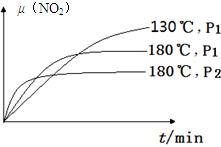
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50 molCH4和a molNO2充入1L的密闭容器中发生反应,测得有关数据如下表:| 实验编号 | 温度 | 时间 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | | 0.15 |
(1)开展实验1和实验2的目的是 。
(2)180℃时,反应到40min,体系 (填“是”或“否”)达到平衡状态,理由是 ;CH4的平衡转化率为 。
(3)已知130℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率μ(NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。

(5)根据已知求算:ΔH2= 。
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1CH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2(16分)有效数字错误或无单位运算或无作答,总扣1分
(1)研究温度对该化学平衡的影响(2分)
(2)是(1分) 温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态。可确定40min时反应已经达平衡状态(2分) 70%(2分)
(3) CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始浓度(mol/L): 0.5 n 0 0 0
变化浓度(mol/L): 0.40 0.80 0.40 0.40 0.80
平衡浓度(mol/L): 0.10 n-0.80 0.40 0.40 0.80 (2分)
则: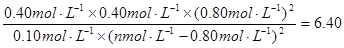 ,解得a=1.2
,解得a=1.2
答:a的值为1.2 (2分)
(4)
(2分,无标注扣1分)
(5)?1160kJ/mol(3分)
(1)研究温度对该化学平衡的影响(2分)
(2)是(1分) 温度升高,反应加快,对比实验1,高温下比低温下更快达到平衡状态。可确定40min时反应已经达平衡状态(2分) 70%(2分)
(3) CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)起始浓度(mol/L): 0.5 n 0 0 0
变化浓度(mol/L): 0.40 0.80 0.40 0.40 0.80
平衡浓度(mol/L): 0.10 n-0.80 0.40 0.40 0.80 (2分)
则:
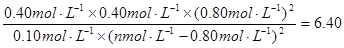 ,解得a=1.2
,解得a=1.2 答:a的值为1.2 (2分)
(4)

(2分,无标注扣1分)
(5)?1160kJ/mol(3分)
试题分析:(1)控制变量进行探究才能尽快得出合理结论,依题意可知,实验1和2的研究目的是温度对化学平衡的影响,其他条件保持不变,仅仅反应温度分别为130℃、180℃;(2)130℃时,反应到40min时甲烷的物质的量保持不变,说明已达平衡,升高温度,反应速率增大,达到平衡的时间缩短,则180℃时,反应到40min,体系一定达到平衡状态;由于平衡时甲烷的物的量保持不变,读表可知平衡时甲烷为0.15mol,由于起始时甲烷为0.50mol,则甲烷的平衡转化率=(0.50—0.15)mol/0.50mol×100%=70%;(3)根据表中数据,130℃时:
CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)起始浓度(mol/L) 0.5 n 0 0 0
变化浓度(mol/L) 0.4 0.8 0.4 0.4 0.8
平衡浓度(mol/L) 0.1 n—0.8 0.4 0.4 0.8
则130℃时该反应的K=[c(N2)×c(CO2)×c2(H2O)]/[c(CH4)×c2(NO2)]=(0.4×0.4×0.82)/[0.1×(n—0.8)2]=6.4, 解得:n=1.2;
(4)180℃、P1变为180℃、P2,就是增大压强,则反应速率增大,平衡左移,二氧化氮的平衡转化率减小,因为正反应是气体体积增大的反应;画图要点为:①起点与180℃、P1时相同;②未达平衡前,180℃、P2时曲线位于180℃、P1时曲线的左边;③180℃、P2时达到平衡的时间小于180℃、P1时;④平衡时,180℃、P2时曲线位于180℃、P1时曲线的下边;
(5)CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g)
N2(g)+CO2(g)+2H2O(g) ΔH=?867 kJ·mol-1,由于系数加倍焓变也加倍,则2CH4(g)+4NO2(g) 2N2(g)+2CO2(g)+4H2O(g) ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g)
2N2(g)+2CO2(g)+4H2O(g) ΔH=?2×867 kJ·mol-1,由于CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g)
4NO(g)+CO2(g)+2H2O(g) ΔH1=?574 kJ·mol-1,根据盖斯定律,前者减去后者可得CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
2N2(g)+CO2(g)+2H2O(g),且焓变等于?1160kJ/mol,故ΔH2=?1160kJ/mol。
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2HI(g) ΔH<0
2HI(g) ΔH<0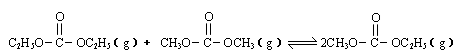 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[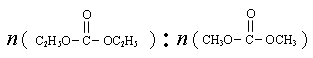 ]分别为3︰1和1︰1、反应物的总物质的量相同时,
]分别为3︰1和1︰1、反应物的总物质的量相同时, 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是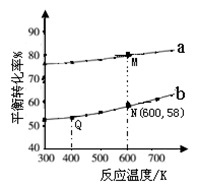
 xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )
xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )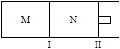

 C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题: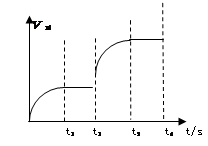
 2C(g) 达到平衡的( )
2C(g) 达到平衡的( )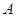 、
、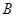 、
、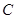 的浓度之比为1:2:2
的浓度之比为1:2:2 ,同时生成2a mol C
,同时生成2a mol C 2NH3 △H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡, t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是
2NH3 △H=-92.4 kJ·mol-1下图是该反应的速率—时间图像,一定条件下,t1时建立平衡, t2时改变某一条件,t3时又建立新平衡,t2时改变的条件可能是