题目内容
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
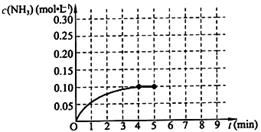
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
⑵下列描述中能说明上述反应已达平衡的是 。
⑶ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”)。
 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
⑵下列描述中能说明上述反应已达平衡的是 。
| A.3v正(H2)=2v逆(NH3) |
| B.容器中气体的平均相对分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
(1)0.025mol/(L·min)(2分,漏写单位扣1分)
(2)BD(2分)
(3)不(2分)
(2)BD(2分)
(3)不(2分)
试题分析:(1)由图判断反应第4分钟时反应达到平衡,v(NH3)=0.1÷4=0.025mol/(L·min);(2)
A、不符合化学计量数关系,错误;B、容器中气体的平均相对分子量是一个不断变化的量,当不变时即达到平衡,正确;C、该容器体积不变,密度是一个恒量,错误;D、分子个数是一个变量,当不变时即达到平衡,正确。(3)改变条件后的平衡与原平衡好是等效平衡,故平衡不移动。

练习册系列答案
相关题目
 2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是
2SO3(气),已知反应过程中某一时SO2、O2、SO3,的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是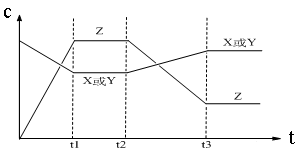
 2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求:
2NH3(g),若开始时只充入2a mol NH3,达到平衡时,混合气体的压强比起始时增大了40%。若开始时充入a mo N2和3a mol H2的混合气体,求: 2HI(g) ΔH<0
2HI(g) ΔH<0 cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施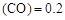 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v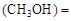 mol /(L·min),
mol /(L·min), 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1