题目内容
下列图示与对应的叙述相符的是
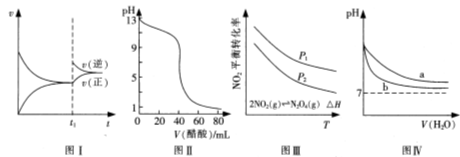

A.图I可表示N2+3H2 2NH3的速率时间图像,t1时刻改变的条件是升高温度 2NH3的速率时间图像,t1时刻改变的条件是升高温度 |
| B.图Ⅱ可表示用0.1 000 mol/L醋酸滴定40.00 mL0.1000 mol/LNaOH溶液得到的滴定曲线 |
| C.图Ⅲ可表示NO2平衡转化率与温度、压强的变化关系,由图可知:△H<0、P1<P2 |
| D.图Ⅳ可表示pH相同的NaOH溶液与氨水稀释过程的pH变化.其中曲线a对应氨水 |
D
试题分析:A、升高温度正逆反应速率均增大,错误;B、醋酸是弱电解质,0.1 000 mol/L醋酸的pH大于1,而且滴定时突变曲线比较平缓,错误;C、图像中有多个变量时要注意定一议一,随温度升高,NO2平衡转化率降低,平衡逆向移动,正向为放热反应,△H<0;相同温度下,压强大平衡正向移动,NO2平衡转化率增大,故P2<P1,错误;D、氨水是弱电解质,加水稀释过程中不断电离产生OH-,使得氨水的pH高于加同样水的氢氧化钠溶液,但随水的量的增加,pH无限接近7,正确。

练习册系列答案
相关题目
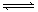 2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是
2Z(g) △H<0。从反应开始经过t1后达到平衡状态,t2时由于条件改变,平衡受到破坏,在t3时又达到平衡,引起t2→t3曲线变化的原因是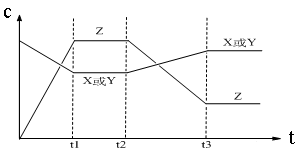
 cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是
cZ(g) ΔH>0,达平衡后,当其他条件不变时,下列说法正确的是 2H2(g)
2H2(g) CH3OH(g)
CH3OH(g) ”或“<”),要提高CO转化率,可采取的措施
”或“<”),要提高CO转化率,可采取的措施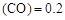 mol/L,则以CH3OH表示的反应速率v
mol/L,则以CH3OH表示的反应速率v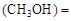 mol /(L·min),
mol /(L·min), 2CO(g) 平衡常数K1
2CO(g) 平衡常数K1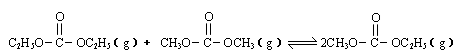 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[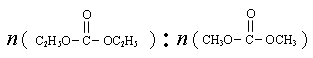 ]分别为3︰1和1︰1、反应物的总物质的量相同时,
]分别为3︰1和1︰1、反应物的总物质的量相同时, 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是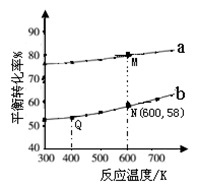
 xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )
xC(g)ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是 ( )

 3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol