题目内容
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
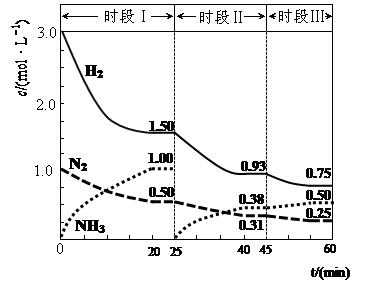
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。

(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
(16分)有效数字错误或无单位扣1分
(1)①0.050mol?L-1?min-1 (2分) 47.2kJ (2分)
② 将NH3从反应体系中分离出去 (2分)
③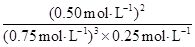 (3分)
(3分)
(2)随温度升高,N2的含量降低 (2分) 主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(2分)
(3)2NH3 + 6OH-—6e-= N2+ 6H2O (3分)
(1)①0.050mol?L-1?min-1 (2分) 47.2kJ (2分)

② 将NH3从反应体系中分离出去 (2分)
③
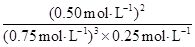 (3分)
(3分)(2)随温度升高,N2的含量降低 (2分) 主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移(2分)
(3)2NH3 + 6OH-—6e-= N2+ 6H2O (3分)
试题分析:(1)①读图可知,前20min内氨气的浓度由0逐渐增大到1.0mol/L,根据定义式可得,v(NH3)=1.0mol/L÷20min=0.050mol/(L?min),注意保留两位有效数字;氮气由1.0mol/L逐渐减小到0.50mol/L,根据c?V=n可求参加反应的氮气的物质的量,即(1.0—0.50)mol/L1L=0.50mol,由于N2(g)+3H2(g)
 2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
2NH3(g) △H=-94.4kJ·mol-1表示1mol氮气反应放出94.4kJ热量,物质的量减半,则放出的热量减半,则 0.50mol氮气反应放出47.2kJ热量;②读图可知,25min时氨气的浓度由1.0mol/L变为0,说明采取的措施是将平衡体系中的氨气及时分离出去,导致氨气的浓度减小,平衡向正反应方向移动,则氨气、氢气的浓度均减小,氨气的浓度由0逐渐增大;③时段III条件下,生成物、反应物的平衡浓度可由图中得出,则氨气、氮气、氢气的平衡浓度分别为0.50mol/L、0.25mol/L、0.75mol/L,代入合成氨的平衡常数表达式可得,K=(0.50mol/L)2/[( 0.25mol/L)×( 0.75mol/L)3];(2)读图可知,在400K~600K时,平衡混合气中氮气含量随温度的升高而降低,而一氧化二氮的含量则随温度升高而增大;观察热化学方程式可知主反应是放热反应,升高温度,导致主反应的平衡左移,所以氮气含量随温度升高而降低(或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移);(3)观察电池总反应式,发现氮元素由—3价升为0价,失去电子,发生氧化反应,而氧元素由0价将为—2价,得到电子,发生还原反应,说明氨气是负极反应物,氧气是正极反应物;根据电子、电荷、原子守恒原理,可以得到NaOH溶液中负极反应式为2NH3 + 6OH-—6e-= N2+ 6H2O,正极反应式为O2+2H2O+4e-="4" OH-。
练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
 CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
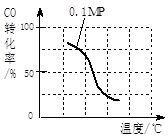

 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是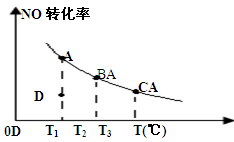
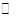 C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)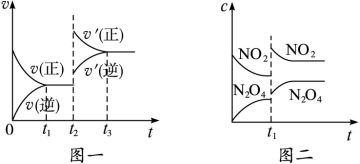
 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
 2SO2(g)+02(g)
2SO2(g)+02(g)  2HI(g)
2HI(g) C0(g)+H2(g)
C0(g)+H2(g)