题目内容
11.室温时下列各组中的物质分别与足量NaOH溶液反应,生成盐种类最多的是( )| A. | Cl2、SO2、H2SiO3、NH4Cl | B. | Al、CO、HCl、Al(NO3)3 | ||
| C. | N2、SiO2、CH3COOH、Na2CO3 | D. | Fe CaO、NH3H2O NaHCO3 |
分析 酸性氧化物和过量氢氧化钠溶液反应生成正盐,氯气和氢氧化钠溶液反应生成钠盐,铝、氧化铝和氢氧化钠溶液反应生成偏铝酸钠.
解答 解:A、C12与足量NaOH溶液反应生成的盐为氯化钠和次氯酸钠;SO2与足量NaOH溶液反应生成的盐为亚硫酸钠;NH4Cl与足量NaOH溶液反应生成的盐为氯化钠;H2SiO3与过量NaOH溶液反应生成的盐为硅酸钠,故A总共4种盐;
B、A1与足量氢氧化钠反应生成的盐为偏铝酸钠;CO与足量NaOH溶液不反应;HCl与足量NaOH溶液反应生成的盐为NaCl;Al(NO3)3与足量NaOH溶液反应生成的盐为硝酸钠和偏铝酸钠,故B总共3种盐;
C、N2与足量NaOH溶液不反应;SiO2与足量NaOH溶液反应生成的盐为硅酸钠;CH3COOH与足量NaOH溶液反应生成的盐为醋酸钠;Na2CO3与足量NaOH溶液不反应,故C总共2种盐;
D、Fe与足量NaOH溶液不反应;CaO与足量NaOH溶液不反应;NH3•H2O与足量NaOH溶液不反应;NaHCO3与足量NaOH溶液反应生成的盐为碳酸钠,故D总共1种盐;
故选A.
点评 本题考查物质的性质,明确物质之间的反应是解本题关键,注意部分酸性氧化物和碱反应与其量有关.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
19.下列解释事实的方程式不正确的是( )
| A. | 铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| B. | 工业进行“氮的固定”:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | 铅蓄电池充电时阴极反应:PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| D. | 用铜和稀硝酸制备硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2 |
6.已知某强酸性的溶液中存在大量的NO3-,下列有关该溶液中还存在的物质叙述正确的是( )
| A. | 铝元素能以Al3+或AlO2-的形式存在 | |
| B. | 铁元素能以Fe2+和Fe3+的形式共存 | |
| C. | 硫元素主要以SO42-的形式存在 | |
| D. | 氯元素能以Cl-或ClO-的形式存在 |
16.下列装置中,铁不易被腐蚀的是( )
| A. |  NaCl溶液 | B. | 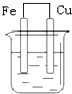 酸化的NaCl溶液 | C. | 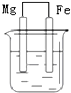 NaCl溶液 | D. |  NaCl溶液 |
3.如图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
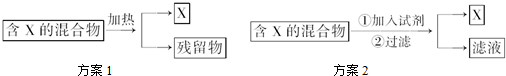

| A. | 可以选用方案1分离碳酸氢钠中含有的氯化铵 | |
| B. | 方案1中残留物可以受热不易挥发 | |
| C. | 方案2中加入的试剂一定能够与除X外的物质发生化学反应 | |
| D. | 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3. |
20.国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17%.下列说法不正确的是( )
| A. | CO2属于酸性氧化物 | |
| B. | CO2是导致酸雨发生的主要原因 | |
| C. | 可用Na2CO3溶液捕捉(吸收)CO2 | |
| D. | 使用氢能源替代化石燃料可减少CO2排放 |
1.下列离子方程式书写不正确的是( )
| A. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
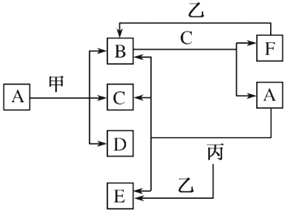
 写出B的化学式Fe2O3
写出B的化学式Fe2O3