题目内容
10.单斜硫和正交硫转化为二氧化硫的能量变化图如所示.下列说法正确的是( )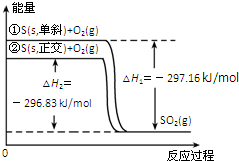
| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
分析 由图象可以看出,单斜硫的能量比正交硫的能量高,物质的能量越高越不稳定,生成SO2的反应为放热反应,以此解答该题.
解答 解:A.单斜硫的能量比正交硫的能量高,S(s,单斜)=S(s,正交)△H=-0.33kJ/mol,为放热反应,故A错误;
B.物质的能量越高越不稳定,则正交硫比单斜硫稳定,故B正确;
C.由图象可以看出,单斜硫燃烧的热化学方程式应为:S(s,单斜)+O2(g)═SO2(g)△H=-297.16kJ•mol-1,故C错误;
D.①式反应需断裂单斜硫中S-S键和O=O键,不仅仅是断裂lmolO2中的共价键所吸收的能量,故D错误.
故选B.
点评 本题考查化学反应与能量的变化,题目难度不大,注意分析能量曲线,判断反应热、活化能与键能的关系.

练习册系列答案
相关题目
20.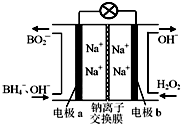 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示.下列说法正确的是( )| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O | |
| C. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| D. | 每消耗3 mol H2O2,转移的电子为3 mol |
18.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成.
| A. | 只有① | B. | 只有①②⑤ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
5.设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 12克金刚石中含有的C-C键数目为为4NA | |
| B. | 1 L 0.1 mol•L-1 NH4Cl溶液中含有0.1NA个NH4+ | |
| C. | 常温常压下,22.4L乙烯与丙烯的混合物中含有的分子数目为NA | |
| D. | 常温常压下,Na2O2与足量H2O反应生成0.2molO2,转移电子的数目为0.4NA |
15.锌溴液流电流是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,其在电解质储罐和电池间不断循环.下列说法不正确的是( )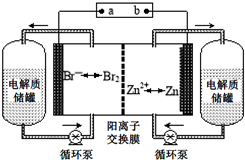

| A. | 放电时负极的电极反应式为Zn-2e-=Zn2+ | |
| B. | 充电时电极a连接电源的负极 | |
| C. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
19.下列解释事实的方程式不正确的是( )
| A. | 铝热法炼铁:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| B. | 工业进行“氮的固定”:N2+3H2$?_{催化剂}^{高温、高压}$2NH3 | |
| C. | 铅蓄电池充电时阴极反应:PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| D. | 用铜和稀硝酸制备硝酸铜:Cu+4H++2NO3-=Cu2++2NO2↑+2H2 |
20.国务院颁布的《“十二五”控制温室气体排放工作方案》提出,2015年我国单位国内生产总值CO2排放要比2010年下降17%.下列说法不正确的是( )
| A. | CO2属于酸性氧化物 | |
| B. | CO2是导致酸雨发生的主要原因 | |
| C. | 可用Na2CO3溶液捕捉(吸收)CO2 | |
| D. | 使用氢能源替代化石燃料可减少CO2排放 |
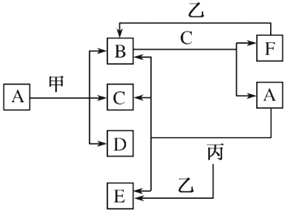
 写出B的化学式Fe2O3
写出B的化学式Fe2O3