题目内容
19.下列各组物质性质的比较中,不正确的是( )| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
分析 A.同周期元素从左到右元素的非金属性逐渐减弱,同主族元素从上到下非金属性减弱,元素的非金属性强,对应的氢化物的稳定性强;
B.碱金属元素从上到下,单质的熔沸点呈逐渐减小趋势;
C.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
D.根据离子核外电子层数的多少以及电子层数与核电核数的关系判断.
解答 解:A.由于非金属性:O>N>P>Si,所以稳定性:H2O>NH3>PH3>SiH4,故A正确;
B.碱金属元素从上到下,原子半径逐渐增大,金属键键能逐渐减小,则单质的熔沸点呈逐渐减小趋势,故B正确;
C.已知非金属性:Cl>S>P>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则有酸性:HClO4>H2SO4>H3PO4>H2SiO3,故C正确;
D.K+核外有3个电子层,离子半径最大,Na+、O2-、F-离子核外电子排布相同,都有2个电子层,根据离子核电核数越大,半径越小可知O2->F->Na+,则有K+>O2->F->Na+,故D错误.故选D.
点评 本题考查元素周期律知识,题目难度不大,本题注意把握元素周期律与元素周期表的关系,注重相关规律、方法的把握.

练习册系列答案
相关题目
10.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA | |
| B. | 常温常压下,7.8gNa2S和Na2O2固体中含有的阴离子总数为0.1NA | |
| C. | 5.6gFe与标准状况下2.24L氯气充分反应失去电子数为0.3NA | |
| D. | 标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
7.将下列5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上 _____+____→_______+_______+_______+H2O 组成一个未配平的化学方程式,正确的顺序是( )
| A. | HNO3、FeSO4;Fe2(SO4)3、Fe(NO3)3、N2O | B. | Fe2(SO4)3、N2O;FeSO4、HNO3、Fe(NO3)3 | ||
| C. | HNO3、Fe2(SO4)3;FeSO4、Fe(NO3)3、N2O | D. | FeSO4、Fe(NO3)3;Fe2(SO4)3、HNO3、N2O |
14.a、b、c、d、e分别为MgC12、KHSO4、KOH、NaHCO3、A1C13溶液中的一种,已知:
①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
①a能与其它4种溶液反应,且a与c、e反应时有明显现象;
②b与d反应只产生气泡;
③e只能与a反应;
下列推理不正确的是( )
| A. | a一定是KOH | B. | c一定是A1C13 | C. | e一定是MgC12 | D. | b一定是KHSO4 |
8.硫代硫酸钠(Na2S2O3)与稀硫酸发生如下反应:Na2S2O3+H2SO4 ═Na2SO4 +SO2 +S↓+H2O,下列四种情况中最早出现浑浊的是( )
| A. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| B. | 20℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL | |
| C. | 10℃时,0.1mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL | |
| D. | 20℃时,0.2mol/L Na2S2O3和0.1mol/L H2SO4各5mL,加水10mL |
11.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol•L-1的Na2CO3溶液中所含钠离子总数为2NA | |
| B. | 标准状况下,22.4L NO与足量O2充分反应,生成的NO2分子数为NA | |
| C. | 常温下,1mol SiC中含有Si-C键的数目为4NA | |
| D. | 常温常压下,33.6L 氯气与足量的铝充分反应,转移电子数为3NA |
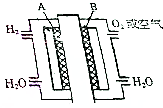 为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;
为体现“绿色奥运”“科技奥运”,2008年北京奥运会出现了中国自己生产的燃料电池汽车,它是以铂作电极,硫酸溶液作电解液,其工作原理如图所示;