题目内容
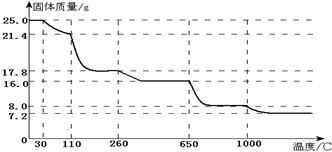
4.某化学兴趣小组对硫酸铜晶体里结晶水的含量进行实验探究.实验步骤为:①取晶体研磨;②用托盘天平称量25.0硫酸铜晶体试样;③加热、冷却;④称量;⑤再加热、冷却和称量;⑥多次测定不同温度下坩埚中固体的质量;⑦当硫酸铜晶体全部变成白色粉末后,继续对白色粉末进行加热,结果又观察到白
色粉末慢慢发生颜色变化,所测定固体质量随温度的升高而变化的曲线如图;
⑧对实验数据进行分析处理.
请回答下列问题:
(1)步骤①需要的实验仪器是研钵.
(2)步骤③具体的操作是:将盛有硫酸铜晶体的坩埚用酒精灯缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体.加热一段时间后,若晶体显蓝色,此时应当继续加热,直到晶体完全变成白色粉末,且不再有水蒸汽逸出,然后将坩埚放在干燥器里冷却.
(3)步骤⑤具体的操作是重复③④的操作,直到连续两次称量的质量差不超过0.1g为止.
(4)110℃时所得固体的化学式是CuSO4•3H2O;,最终所得固体的化学式是Cu2O请从中学化学课本中举出一例能生成该物质的化学方程式CH3CHO+2Cu(OH)2△→△→CH3COOH+Cu2O↓+2H2O.
(5)通过实验探究可知,进行硫酸铜晶体中结晶水含量测定的实验时,温度控制在260℃~650℃范围里.
分析 (1)研碎硫酸铜晶体需要在研钵中进行;
(2)若晶体显蓝色,则硫酸铜晶体中的结晶水没有完全失去,需要继续加热直至变成白色粉末;硫酸铜会吸收结晶水,所以干燥时需要在干燥器中进行;
(3)托盘天平的最小读数为0.1g,则重复③至④的操作,直到连续两次称量的质量差不超过0.1 g为止,以此检验样品中结晶水是否已经全部除去;
(4)110℃时固体质量为21.4g,利用差量法设计成此时硫酸铜晶体中的结晶水数目;最终得到固体的质量为7.2g,该物质应该为铜的氧化物,根据质量守恒定律计算出铜的质量及物质的量,再计算出氧元素的物质的量,从而得出该物质的化学式;联系所学知识写出满足条件的化学方程式;
(5)温度低于260℃,硫酸铜晶体中的结晶水不会完全失去,650℃之前固体质量为16g,说明结晶水已经完全失去,若温度高于650℃,则会导致硫酸铜分解;而,几次判断加热硫酸铜晶体的温度范围.
解答 解:(1)需要在研钵中研碎硫酸铜晶体,故答案为:研钵;
(2)加热时要加热充分,若晶体显蓝色,说明结晶水还没有完全失去,应该继续加热,直到硫酸铜晶体完全变成白色粉末,且不再有水蒸气逸出再停止加热;冷却时放在干燥器中,避免吸收空气中的水,引起误差,
故答案为:继续加热,直到晶体完全变成白色粉末,且不再有水蒸汽逸出;干燥器;
(3)0.1 g是托盘天平的感量,两次称量误差不超过0.1 g,完全可以说明晶体中的结晶水已全部失去
用加热的方法除去CuSO4•5H2O中的结晶水,为了避免加热时间过长或温度过高造成的CuSO4分解,就不可避免的没有使CuSO4•5H2O中结晶水全部失去,这势必会造成新的误差,为此,本实验采取了多次加热的方法,以尽可能的使晶体中的结晶水全部失去,0.1 g是托盘天平的感量,两次称量误差不超过0.1 g,完全可以说明晶体中的结晶水已全部失去,所以重复③至④的操作,直到连续两次称量的质量差不超过0.1 g为止,以此检验样品中结晶水是否已经全部除去,
故答案为:连续两次称量的质量差不超过0.1g为止;
(4)CuSO4•5H2O~CuSO4•xH2O△m
250 18(5-x)
25.0g 25.0g-21.4g=3.6g
则:25025.025025.0=18(5−x)3.6,
解得:x=3,
所以在110℃时所得固体的成分为CuSO4•3H2O;
25.0g胆矾的物质的量为:25g250g/mol=0.1mol,最终得到的固体质量为7.2g,Cu元素守恒可知,该固体中含有0.1molCu元素,质量为:64g/mol×0.1mol=6.4g,含有氧元素的质量为:7.2g-6.4g=0.8g,含有氧原子的物质的量为:0.8g16g/mol=0.05mol,n(Cu):n(O)=0.1mol:0.05mol=2:1,则最终得到的物质为:Cu2O,乙醛与新制的氢氧化铜浊液反应也可以得到氧化亚铜,反应的方程式为:CH3CHO+2Cu(OH)2△→CH3COOH+Cu2O↓+2H2O,
故答案为:CuSO4•3H2O; Cu2O;CH3CHO+2Cu(OH)2△→CH3COOH+Cu2O↓+2H2O;
(5)根据图象可知,650℃前固体质量为16g,说明结晶水已经完全失去,若温度高于650℃,则硫酸铜分解,影响测定结果;而温度低于260℃,硫酸铜晶体中的结晶水不会完全失去,所以加热硫酸铜晶体的温度范围为:260℃~650℃,
故答案为:260℃~650℃.
点评 本题考查硫酸铜晶体中结晶水含量的测定,题目难度中等,明确测定原理为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,(4)为难点,需要利用质量守恒进行计算.

| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
 四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )
四种短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y是地球上含量最高的金属元素.下列判断正确的是( )| A. | 1molW的单质在足量空气中燃烧转移电子数是6NA | |
| B. | 含Y元素的盐溶液可能显酸性,也可能显碱性 | |
| C. | Z元素的单质和氧化物不能与任何酸发生反应 | |
| D. | X与H、O元素形成的化合物一定是共价化合物 |
| A. | 乙烯的分子式:CH2=CH2 | |
| B. | NaHCO3的电离:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的结构式:Na-O-H | |
| D. | NH4Cl的电子式: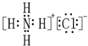 |
| A. | 热稳定性SiH4<PH3<NH3<H2O | B. | 熔点:Na>K>Rb>Cs | ||
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO4 | D. | 半径:K+>Na+>O2->F- |
| A. | 向某溶液中滴入石蕊呈红色,滴入甲基橙则呈黄色,则该溶液的pH值可能为4.4~5.0 | |
| B. | 电解水时加入H2SO4、NaOH、CuCl2等电解质均可增加导电性,而会使电解水的速率增大 | |
| C. | 配制标准NaOH溶液的NaOH固体含有少量的KOH,此时中和测得盐酸的浓度数值一定偏高 | |
| D. | 电解饱和食盐水一段时间,若向某一极滴入酚酞试液后溶液呈红色,该极一定是阴极 |
 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.