题目内容
(1)将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),判断下列情况下容器中金属离子与金属单质的存在情况:(用符号表示)
①若Fe粉有剩余,则容器中不可能有____________;
②若FeCl3有剩余,则容器中不可能有___________;
③若CuCl2有剩余,则容器中还可能有____________。
(2)有一瓶无色澄清溶液,可能含NH4+、K+、Na +、Mg2+、Ba2+、 Al3+、 Fe3+、SO42-、CO32-、Cl-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈酸性;
②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;
③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;
④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成;
⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:在溶液中肯定存在的离子有 ,肯定不存在的离子有 ,要确定是否存在的阴离子的实验方法是____________ 。
(1)①Fe3+和Cu2+ ②Fe和Cu ③Fe2+、Fe3+ (或Cu Fe2+)
(2)I-、NH4+、Ba2+; SO42-、CO32-、Mg2+、Al3+ 、Fe3+; 取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
解析试题分析:(1)①由于Fe会发生反应:2Fe3++Fe=3Fe2+;Cu2++Fe=Fe2+ +Cu。因此若Fe粉有剩余,则容器中不可能有Fe3+和Cu2+。②由于FeCl3会发生反应:2Fe3++Fe=3Fe2+;2Fe3++Cu=2Fe2+ +Cu2+.因此若FeCl3有剩余,则容器中不可能有Fe和Cu。③由于CuCl2会发生反应:Cu2++Fe=Fe2+ +Cu若CuCl2有剩余,则容器中不可能有Fe;还可能有Fe2+、Fe3+(或Cu Fe2+)。(2)①用pH试纸检验,表明溶液呈酸性,说明含有大量的H+。由于H+会发生反应:CO32-+2H+=CO2↑+H2O,所以没有CO32-;②取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡后静置,CCl4层呈紫红色;说明发生反应:Cl2+2I-=2Cl-+I2。原溶液中含有I-。由于I-会发生反应:2Fe3++2I-=2 Fe2++I2,故溶液中不含有Fe3+。③取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成;证明不含有Mg2+、Al3+。因为若含有它们,则会发生反应:Al3++3OH-=Al(OH)3↓;Mg2++2OH-=Mg(OH)2↓.④取部分上述呈碱性的溶液,加Na2CO3溶液,有白色沉淀生成,证明含有Ba2+,不含SO42-。发生的反应为:Ba2++ CO32-=BaCO3↓。而Ba2+与SO42-因为发生离子反应:SO42-+Ba2+=BaSO4↓而不能大量共存。⑤将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。放出的气体为氨气,则原溶液中含有NH4+。反应的方程式为:NH4++ OH- NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
NH3↑+H2O。综上所述,在溶液中肯定存在的离子有I-、NH4+、Ba2+;肯定不存在的离子有SO42-、CO32-、Mg2+、Al3+ 、Fe3+;根据溶液呈电中性原理,则溶液中还应该含有阴离子.要确定是否存在的阴离子的实验方法是取少量溶液于试管中,滴加稀硝酸,再滴加硝酸银溶液,如果有白色沉淀出现,说明含有该阴离子,否则不含有该阴离子。
考点:考查离子的鉴定的知识。

 阅读快车系列答案
阅读快车系列答案若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。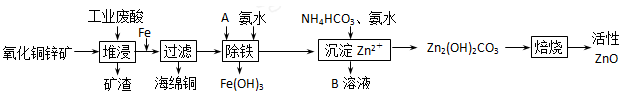
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。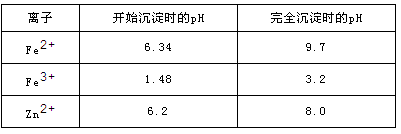
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
(1)溶液中一定存在的离子是 ;溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤) 。
(3)写出实验⑤中所有反应的离子方程式: 。
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含的离子如下表所示:
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3—、SO42— |
取等质量的三种化合物配制成相同体积的溶液,其溶质的物质的量浓度:c(甲)>c(乙)>c(丙)。
(1)甲是________,向AlCl3溶液中逐滴加入甲溶液,观察到的现象是________,对应的离子方程式为________。
(2)乙是______,设计实验确定乙的物质组成________(若乙已确定,则不填该空)。
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | 氨水物质的量浓度/(mol·L-1) | 盐酸物质的量浓度/(mol·L-1) | 混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl

 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol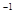 ;
;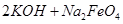 =
=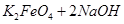 ,说明此温度下
,说明此温度下 __________
__________ 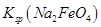 (填“>”或“<”)。
(填“>”或“<”)。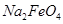 完全转化为
完全转化为 ,若最终制得粗产品
,若最终制得粗产品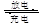 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。