题目内容
(17分)铁及其化合物在日常生活、生产中应用广泛。氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。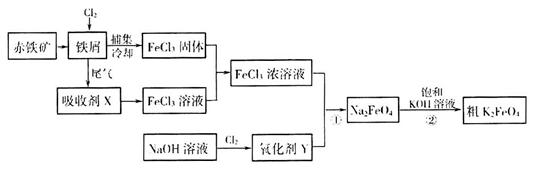
请回答下列问题
(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol ;
;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol
2CO(g)△H=+172.5KJ·mol ;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)
;用赤铁矿为原料在高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H= KJ·mol
2Fe(s)+3CO2(g)△H= KJ·mol 。
。
(2)吸收剂x的溶质为____________(写化学式)。
(3)氧化剂Y为“84消毒液”的有效成分,则在碱性条件下反应①的离子方程式为
__________________________________________________________________
(4)过程②是在某低温下进行的,反应的化学方程式为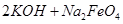 =
=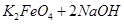 ,说明此温度下
,说明此温度下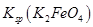 __________
__________ 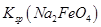 (填“>”或“<”)。
(填“>”或“<”)。
假定此过程中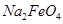 完全转化为
完全转化为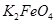 ,若最终制得粗产品
,若最终制得粗产品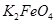 206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
206.25t,产品纯度为96%,则理论上至少需要氧化剂Y的质量是___________t。
(5)高铁电池是一种新型二次电池,电解液为强碱溶液,其电池反应为:3Zn+2K2FeO4+8H2O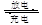 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
(1)-28.5 (3分) (2)FeCl2(3分)
(3)2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O(3分)
(4)< (2分) 111.75(3分)
(5)Zn+2OH--2e-="=" Zn(OH)2(3分)
解析试题分析:(1)已知:①Fe2O3(s)+3C(石墨) 2Fe(s)+3CO(g)△H=+489.0KJ·mol—1;
2Fe(s)+3CO(g)△H=+489.0KJ·mol—1;
②C(石墨)+CO2(g) 2CO(g)△H=+172.5KJ·mol—1;根据盖斯定律:①—②×3得
2CO(g)△H=+172.5KJ·mol—1;根据盖斯定律:①—②×3得
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H=-28.5KJ·mol—1。(2)根据题给流程知,尾气氯气与吸收剂x反应生成氯化铁溶液,则吸收剂x的溶质为FeCl2。(3)根据题给流程知,“84消毒液”的有效成分次氯酸钠在碱性条件下与三氯化铁溶液反应生成高铁酸钠,利用化合价升降法结合原子守恒、电荷守恒知,该反应的离子方程式为2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O;(4)由题给反应知,高铁酸钠在在某低温下转化为高铁酸钾,根据沉淀转化知识知,沉淀易向更难溶的方向转化,,说明此温度下Ksp(K2FeO4)<Ksp(K2FeO4)。由题给反应得关系式:3NaClO——2K2FeO4,将题给数据代入关系式计算得需要氧化剂NaClO的质量是111.75t。(5)由题给电池反应知,该电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2。
2Fe(s)+3CO2(g)△H=-28.5KJ·mol—1。(2)根据题给流程知,尾气氯气与吸收剂x反应生成氯化铁溶液,则吸收剂x的溶质为FeCl2。(3)根据题给流程知,“84消毒液”的有效成分次氯酸钠在碱性条件下与三氯化铁溶液反应生成高铁酸钠,利用化合价升降法结合原子守恒、电荷守恒知,该反应的离子方程式为2Fe3++3ClO-+10OH-="=" 2FeO42-+3Cl-+5H2O;(4)由题给反应知,高铁酸钠在在某低温下转化为高铁酸钾,根据沉淀转化知识知,沉淀易向更难溶的方向转化,,说明此温度下Ksp(K2FeO4)<Ksp(K2FeO4)。由题给反应得关系式:3NaClO——2K2FeO4,将题给数据代入关系式计算得需要氧化剂NaClO的质量是111.75t。(5)由题给电池反应知,该电池放电时,负极上锌失电子和氢氧根离子反应生成氢氧化锌,电极反应式为:Zn+2OH--2e-=Zn(OH)2。
考点:考查焓变的计算、盖斯定律,离子方程式的书写,关系式法计算及化学电源。

 小题狂做系列答案
小题狂做系列答案下列物质中,属于非电解质的是
| A.盐酸 | B.NaCl | C.蔗糖 | D.铜 |
(14分)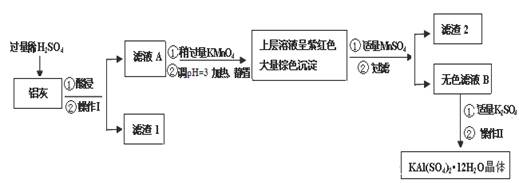
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。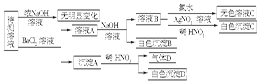
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| | 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | | | | |
(2)待测溶液中是否有SO32-、SO42- 。若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为 ,形成沉淀B时反应的离子方程式为 。
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是 。
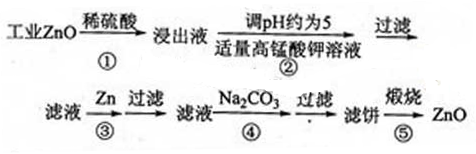
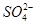 、
、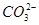 两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作: