题目内容
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)S2-+Cl2 S↓+2Cl-
S↓+2Cl-
(3)产生大量白烟,8NH3+3Cl2 6NH4Cl+N2
6NH4Cl+N2
(4)饱和食盐水 (6)略
解析试题分析:(1)A为实验室制取氯气的反应,离子方程式为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)B中出现黄色浑浊现象,说明氯气与硫化钠反应有硫单质生成,离子方程式为2-+Cl2 S↓+2Cl-
S↓+2Cl-
(3)E中产生氨气,经干燥的氯气与氨气反应有不是固体氯化铵生成,所以D中有白烟产生,化学方程式为8NH3+3Cl2 6NH4Cl+N2
6NH4Cl+N2
(4)因为浓盐酸易挥发,若不除去,与氨气发生化合反应生成氯化铵,也有白烟出现,不能证明氯气与氨气发生了氧化还原反应,所以在C前加一洗气装置,洗气装置盛装试剂为饱和食盐水
(5)证明氧化性Cl2>S,可以比较高氯酸与硫酸的酸性强弱。
考点:考查氯、硫非金属性的比较,氯气的实验室制法,离子方程式、化学方程式的书写,实验现象的判断分析

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案某待测溶液中可能含有SO42-、SO32-、CO32-、HCO3-、NO3-、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出)。
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填)。
| | 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | | | | |
(2)待测溶液中是否有SO32-、SO42- 。若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为 ,形成沉淀B时反应的离子方程式为 。
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是 。
Ⅰ.高铁酸钾(K2FeO4)是极好的氧化剂,具有高效的消毒作用,为一种新型非氯高效消毒剂。其生产工艺流程如下: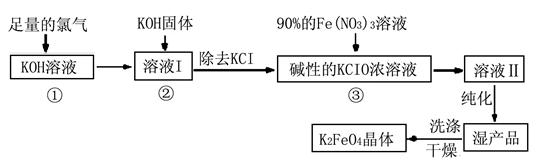
请同答下列问题。
(1)写出向KOH溶液中通入足量Cl2发生反应的离子方程式 。
(2)在溶液I中加入KOH固体的目的是 (选填序号)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解会放出较多的热量,有利于提高反应速率和KClO的纯度 |
(4)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH
 3Zn+2K2FeO4+8H2O,
3Zn+2K2FeO4+8H2O,放电时电池的负极反应式为 。
Ⅱ.肼(N2H4)又称联氨,是一种可燃性的液体,用作火箭燃料。
(5)写出肼分子的电子式 。
(6)肼能与N2O4反应:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=-1076.7 kJ/mol。
已知:N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ/mol, 写出肼与O2反应生成N2和H2O(g)的热化学方程式 。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为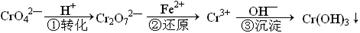
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
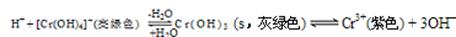
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-33 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 .第③步反应后,过滤沉淀时需要的玻璃仪器有 .若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式_____________________________________________