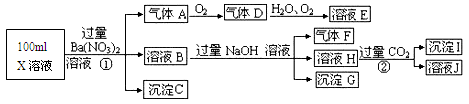
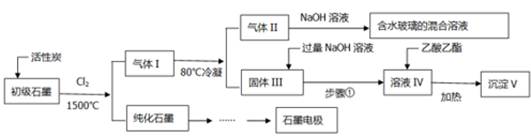
题目内容
(10分)某科研小组设计出利用工业废酸(l0%)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,如下图所示。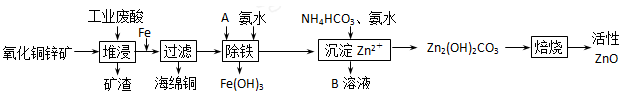
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。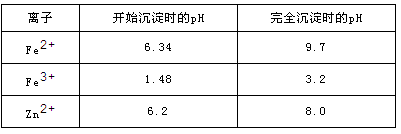
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,则相同温度下:Ksp(CuS)______Ksp(ZnS)(选填“>”“<”或“=”)。
(2)物质A可使用下列物质中的 。
| A.KMnO4 | B.O2 | C.H2O2 | D.Cl2 |
(4)物质B可直接用作氮肥,则B的化学式是________。
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式__________。
(1) < (2) B C (3)3.2≤pH﹤6.2 (4) (NH4)2SO4
(5)2Fe(OH)3+3ClO-+4OH-=== 2FeO42-+3Cl-+5H2O
解析试题分析:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)<Ksp(ZnS);
(2)除铁过程中加入A和氨水,使亚铁离子变成氢氧化铁沉淀,故A应为氧化剂,考虑不引入新的杂质,应选BC;
(3)从图表数据可知,铁离子沉淀完全的PH为3.2,锌离子开始沉淀的PH为6.2.故除铁PH范围为:3.2~6.2;
(4)因所用废酸为硫酸,B又可作氮肥,所以B为(NH4)2SO4;
(5)由题给信息可知,反应物为2Fe(OH)3、ClO-、OH-,生成物之一为FeO42-,因铁在反应中化合价升高,故氯的化合价降低,故另一产物为Cl-,根据元素守恒,还有水是产物.根据化合价升降法配平此方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O。
考点:考查物质制备工艺流程图相关知识。

能在透明溶液中大量共存的一组离子是
| A.Na+、NH4+、OH-、HCO3- | B.Mg2+、Ag+、NO3-、SiO32- |
| C.K +、Cu2+、Cl-、SO42- | D.H+、Fe3+、I-、ClO- |
(14分)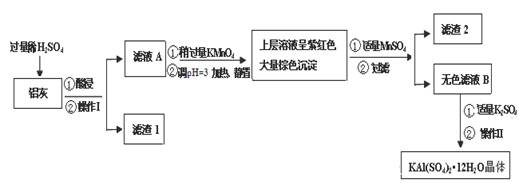
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为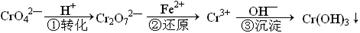
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显 色。
(2)能说明第①步反应达平衡状态的是 。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
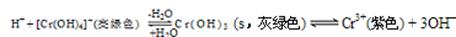
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为 ,溶液中离子浓度由大到小的顺序为 。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以 形式存在(填写离子符号)。