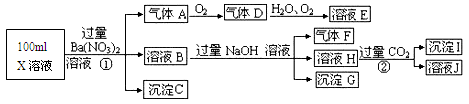
题目内容
若溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是:
| A.Al3+ Na+NO3- Cl- | B.K+ Na+Cl- NO3- |
| C.K+ Na+ Cl-AlO2- | D.K+ NH4+ SO42-NO3- |
B
解析试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。溶液中由水电离产生的C (OH-)=1×10-14mol·L-1,这说明该溶液中水的电离平衡是被抑制的,所以溶液可能显酸性,也可能显碱性。如果溶液显酸性,则AlO2-不能大量共存。如果溶液显碱性,则Al3+、NH4+均不能大量共存,因此正确的答案选B。
考点:考查离子共存的正误判断
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验。有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题需要明确离子不能大量共存的一般情况,即(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。

练习册系列答案
相关题目
能在透明溶液中大量共存的一组离子是
| A.Na+、NH4+、OH-、HCO3- | B.Mg2+、Ag+、NO3-、SiO32- |
| C.K +、Cu2+、Cl-、SO42- | D.H+、Fe3+、I-、ClO- |
下列物质中,属于非电解质的是
| A.盐酸 | B.NaCl | C.蔗糖 | D.铜 |
下列离子能够大量共存,且满足相应要求的是
| 选项 | 离 子 | 要 求 |
| A | NH、Al3+、SO、H+ | 滴加NaOH溶液立刻有气体产生 |
| B | K+、NO、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO、SO、Cl- | 逐滴滴加盐酸时溶液没有颜色变化 |
| D | Na+、HCO、Mg2+、SO | 滴加氨水立即有沉淀产生 |
下列文字表述与反应方程式对应且正确的是
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素: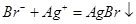 |
B.用醋酸除去水垢: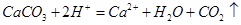 |
C.苯酚钠溶液中通入少量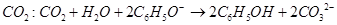 |
D.实验室用液溴和苯在催化剂作用下制溴苯: |
下列离子组能大量共存的是
| A.Ba2+、Cl-、SO42-、K+ | B.Mg2+、SO42-、Na+、Cl- |
| C.H+、CO32-、Al3+、Cl- | D.K+、Fe2+、NO3-、H+ |