题目内容
(8分)将10g铁置于40 mL某浓度的硝酸中,再微热充分反应后,共收集到NO,NO2混合气体1792 mL,溶液里还残留4.4g固体(标准状况)。求:
(1)NO的体积为 mL,NO2的体积为 mL。
(2)则原硝酸溶液的浓度为 mol/L。
(3)欲使铁与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要质量分数为30%的双氧水 _g。(保留一位小数)
(1)NO的体积为 mL,NO2的体积为 mL。
(2)则原硝酸溶液的浓度为 mol/L。
(3)欲使铁与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要质量分数为30%的双氧水 _g。(保留一位小数)
(1)1344, (2分)448(2分) (2)7 mol/L(2分) (3)11.3(2分)
(1)溶液中残留固体,说明铁是过量的,因此溶液中生成的是硝酸亚铁,参加反应的铁是10g-4.4g=5.6g,物质的量是0.1mol,失去电子是0.2mol,NO、NO2混合气体是
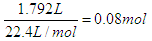 。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
(2)硝酸亚铁是0.1mol,根据原子守恒可知原硝酸的物质的量是0.1mol×2+0.08mol=0.28mol,
其浓度是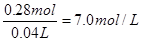 。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
少需要质量分数为30%的双氧水是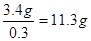 。
。
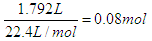 。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。
。根据得失电子守恒可知3n(NO)+n(NO2)=2mol,n(NO)+n(NO2)=0.08mol,解得NO的物质的量是0.06mol,NO2是0.02mol,其体积分别为0.06mol×22.4L/mol=1.344L,0.02mol×22.4L/mol=0.448L。(2)硝酸亚铁是0.1mol,根据原子守恒可知原硝酸的物质的量是0.1mol×2+0.08mol=0.28mol,
其浓度是
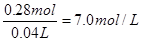 。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至
。根据得失电子守恒可知双氧水得到的电子就相当于是铁失去的电子,1mol双氧水得2mol电子,所以需要双氧水得物质的量是0.1mol,其质量是3.4g,因此至少需要质量分数为30%的双氧水是
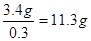 。
。
练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案
相关题目
 CO2↑+2H2O+2SO2↑
CO2↑+2H2O+2SO2↑