题目内容
(8分)(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_________________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
如下反应:Mn2++S2O82-+H2O→MnO4-+SO42-+H+
该反应常用于检验Mn2+的存在。其特征现象是_________________。
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量__________mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(3)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4— Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
(1)溶液由无色变为紫色 0.25 (2)Cl2
(3)10 4 14 = 3 5 4 14 (2)Bi2(SO4)3
(3)10 4 14 = 3 5 4 14 (2)Bi2(SO4)3
(1)由于MnO4-在溶液中显紫红色,所以现象是溶液由无色变为紫色;还原剂是Mn2+,化合价从+2价升高到+7价,所以失去5个电子;氧化剂中S的化合价从+7价降低到+6价,得到1个电子,所以1mol氧化剂得到2mol电子,因此若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量0.25mol。
(2)由于在反应中氯离子也能被氧化,所以还生成氯气。
(3)根据方程式可知,Bi的化合价从+5价降低到+3价,得到2个电子。MnSO4中Mn的化合价从+2价升高到+7价,失去5个电子,所以氧化剂是NaBiO3,还原剂是MnSO4,二者的物质的量之比是5︰2,其中还原产物是Bi2(SO4)3,氧化产物是NaMnO4,因此方程式为
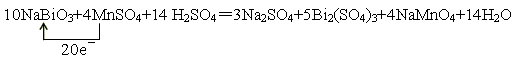
(2)由于在反应中氯离子也能被氧化,所以还生成氯气。
(3)根据方程式可知,Bi的化合价从+5价降低到+3价,得到2个电子。MnSO4中Mn的化合价从+2价升高到+7价,失去5个电子,所以氧化剂是NaBiO3,还原剂是MnSO4,二者的物质的量之比是5︰2,其中还原产物是Bi2(SO4)3,氧化产物是NaMnO4,因此方程式为
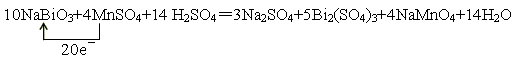

练习册系列答案
相关题目
 Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是
Fe2O3+2NH3↑+N2↑+4SO2↑+17H2O,下列说法正确的是 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。 2K2FeO4+3KNO2+2H2O。下列说法正确的是
2K2FeO4+3KNO2+2H2O。下列说法正确的是 PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。
PbO2+2Pb(NO3)2+2H2O。铅丹的化学式是 ,此铅丹中铅的化合价是 。由此反应可推测PbO是(填“酸”或“碱”) 性氧化物。