题目内容
15. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.Na2CO3 c.NaClO
pH由小到大排列的顺序是a<c<b(用编号填写).
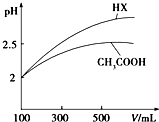
(2)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.稀释后,HX溶液中水电离出来的C(H+)大于(填“大于”、“小于”或“等于”)醋酸溶液中水电离出来的C(H+).
分析 (1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大;
(2)平衡常数随温度变化,由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小.
解答 解:(1)由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,则水解程度为b>c>a,pH由小到大的顺序是a<c<b,
故答案为:a<c<b;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力弱,所以HX溶液中水电离出来的c(H+)大,
故答案为:大于;大于.
点评 本题考查盐类水解及酸性的比较、pH与酸的稀释等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.

练习册系列答案
相关题目
5.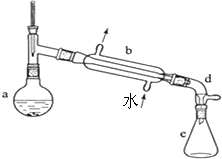 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
实验步骤:
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
3.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )
| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |
10.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)=1×10-12mol/L.若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度大于(填“大于”、“等于”或“小于”)氨水中水的电离程度.
(2)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡向左移动(填“向正反应方向”、“向逆反应方向”或“不”).
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g)?4NO2(g)+O2(g).下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率v(N2O5)=3×10-3mol•L-1•s-1;降温至T2,反应迸行l000s时测得c(NO2)=4.98mol•L-1,则反应2N2O5(g)?4NO2(g)+O2(g)的△H<0.(填“>”、“=“或“<“).
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通人空气,另一电极通入NH3.其电池反应式为:4NH3+3O2=2N2+6H2O.你认为电解质溶液应显碱性(填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式O2+2H2O+4e-=4OH-.
(1)常温下,某氨水的pH=12,则水电离的c(OH-)=1×10-12mol/L.若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度大于(填“大于”、“等于”或“小于”)氨水中水的电离程度.
(2)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡向左移动(填“向正反应方向”、“向逆反应方向”或“不”).
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g)?4NO2(g)+O2(g).下表为反应在T1温度下的部分实验数据:则500s内N2O5的分解速率v(N2O5)=3×10-3mol•L-1•s-1;降温至T2,反应迸行l000s时测得c(NO2)=4.98mol•L-1,则反应2N2O5(g)?4NO2(g)+O2(g)的△H<0.(填“>”、“=“或“<“).
| t(秒) | 0 | 500 | 1000 |
| N2O5浓度mol•L-1 | 5.00 | 3.50 | 2.42 |
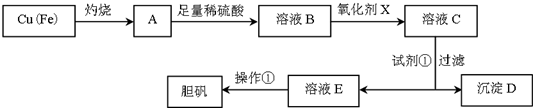
20.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程.
已知:
请回答:
(1)溶液B中含有的阳离子有Fe2+、Fe3+、H+、Cu2+(填离子符号).
(2)下列物质中最适宜作氧化剂X的是b(填字母).a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(4)操作①的名称是蒸发浓缩、冷却结晶.
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是c
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(6)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液.实验室保存FeCl2溶液,需加入过量的铁粉,其原因是2Fe3++Fe=3Fe2+(用离子方程式表示).

已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
(1)溶液B中含有的阳离子有Fe2+、Fe3+、H+、Cu2+(填离子符号).
(2)下列物质中最适宜作氧化剂X的是b(填字母).a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(4)操作①的名称是蒸发浓缩、冷却结晶.
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是c
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(6)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液.实验室保存FeCl2溶液,需加入过量的铁粉,其原因是2Fe3++Fe=3Fe2+(用离子方程式表示).
7.对于在在标准状况下,22.4LO2中说法是正确的是( )
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |
4.下列各项中,由实验事实能得出相应结论的是( )
| 选项 | 理由 | 结论 |
| A | 相同物质的量浓度溶液的pH: Ca(ClO)2>CH3COONa | 酸性:CH3COOH>HClO |
| B | 同体积相同pH的盐酸和醋酸与相同的锌 反应的速率:醋酸>盐酸 | 酸性:HCl>CH3COOH |
| C | 相同条件下的沸点: H2O>NH3 | 非金属性:O>N |
| D | 相同物质的量得到电子的数目: 稀硝酸>浓硝酸 | 氧化性:稀硝酸>浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
5.(CH3)2CHCH2OH是某有机物的加氢还原产物,该有机物可能是( )
| A. | 乙醛的同系物 | B. | 丙醛的同分异构体 | ||
| C. | CH2=C(CH3)CHO | D. | CH3CH2COCH3 |
