题目内容
20.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程.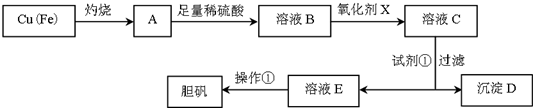
已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
(1)溶液B中含有的阳离子有Fe2+、Fe3+、H+、Cu2+(填离子符号).
(2)下列物质中最适宜作氧化剂X的是b(填字母).a.NaClO b.H2O2 c.KMnO4
(3)加入试剂①是为了调节pH,试剂①可以选择CuO或CuCO3或Cu(OH)2(填化学式).
(4)操作①的名称是蒸发浓缩、冷却结晶.
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是c
a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
b.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
c.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
d.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(6)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液.实验室保存FeCl2溶液,需加入过量的铁粉,其原因是2Fe3++Fe=3Fe2+(用离子方程式表示).
分析 由制备实验流程可知,Fe和Cu灼烧,铜与氧气反应生成CuO,Fe与氧气不能完全反应,加入稀硫酸,反应生成硫酸铜和硫酸亚铁、硫酸铁,为了除去二价铁,由完全生成氢氧化物沉淀时溶液的pH可知,需将二价铁氧化生成三价铁,然后调节pH形成沉淀,过滤除去氢氧化铁沉淀,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得胆矾,据此解答.
解答 解:由制备实验流程可知,Fe和Cu灼烧,铜与氧气反应生成CuO,Fe与氧气不能完全反应,加入稀硫酸,反应生成硫酸铜和硫酸亚铁、硫酸铁,为了除去二价铁,由完全生成氢氧化物沉淀时溶液的pH可知,需将二价铁氧化生成三价铁,然后调节pH形成沉淀,过滤除去氢氧化铁沉淀,滤液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得胆矾,
(1)根据上面的分析可知,溶液B为硫酸铜和硫酸亚铁、硫酸铁混合溶液及过量的稀硫酸,其中含有的阳离子有Fe2+、Fe3+、H+、Cu2+,
故答案为:Fe2+、Fe3+、H+、Cu2+;
(2)氧化剂X是将亚铁离子氧化成铁离子,同时不能引入新的杂质,所以可以用H2O2,故选b;
(3)加入试剂①是为了调节pH,与溶液中的氢离子反应,同时不能引入新的杂质,试剂①可以选择CuO或CuCO3或Cu(OH)2,
故答案为:CuO或CuCO3或Cu(OH)2;
(4)操作①是从硫酸铜 溶液中获得硫酸铜晶体,其名称是蒸发浓缩、冷却结晶,
故答案为:蒸发浓缩、冷却结晶;
(5)a.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体为氢氧化铁胶体,氢氧化铁胶体能产生丁达尔效应,故a正确;
b.向FeCl3溶液滴加NaOH溶液,生成氢氧化铁红褐色沉淀,故b正确;
c.将FeCl3溶液加热蒸干并灼烧,由于氯化铁水解,最终得到Fe2O3固体,故c错误;
d.向FeCl3溶液中滴加KSCN溶液生成Fe(SCN)3,溶液变为红色,故d正确,
故选c;
(6)实验室保存FeCl2溶液,为防止其中亚铁离子被氧化需加入过量的铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查了铜及其化合物性质分析,化学方程式计算,掌握制备的原理和计算的依据基础是关键,题目难度中等.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| C. | 醋酸的电离程度增大,[H+]亦增大 | |
| D. | 再加入10mlpH=11的NaOH溶液,混合液pH=7 |
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.Na2CO3 c.NaClO
pH由小到大排列的顺序是a<c<b(用编号填写).
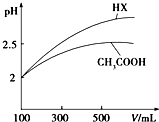
(2)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.稀释后,HX溶液中水电离出来的C(H+)大于(填“大于”、“小于”或“等于”)醋酸溶液中水电离出来的C(H+).
| A. | H2 | B. | CO2 | C. | CO | D. | NH3 |
| A. | 二氧化硫可用作一些食品的杀菌剂 | |
| B. | 明矾[KAl(SO4)2•12H2O]既可用做净水剂,也可用作消毒剂 | |
| C. | 浓硫酸、浓硝酸均具有强氧化性,常温下均可用铝制容器盛放 | |
| D. | NH4HCO3受热易分解放出NH3和CO2,可用作制作糕点时的发酵剂、膨松剂 |
 某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).
某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色. |
| Ⅱ | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
| Ⅲ | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成. |
| Ⅳ | 一段时间后,用注射器取出少量B装置中的溶液,… | … |
| Ⅴ | 打开活塞a,通入一段时间空气 | ---- |
(1)保存Fe(NO3)2溶液时,常加入铁粉,目的是(用化学方程式表示)2Fe(NO3)3+Fe═3Fe(NO3)2.
(2)实验Ⅰ中,发生反应的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(3)资料表明,Fe2+能与NO结合形成深棕色物质[Fe(NO)]2+:Fe2++NO?[Fe(NO)]2+
用平衡移动原理解释实验I中溶液由深棕色变为黄色的原因是Fe2+被稀硝酸氧化为Fe3+,使溶液中c(Fe2+)逐渐下降(同时NO的逐渐逸出,也使溶液中c(NO)逐渐下降),平衡Fe2++NO?[Fe(NO)]2+左移,溶液棕色褪去,显示出Fe3+的黄色..
(4)分析实验现象,同学们得出了结论.则:
①实验Ⅳ的后续操作是加入K3[Fe(CN)6]溶液,观察到的现象是生成蓝色沉淀.
②由实验得出的结论是氧化性:NO3->Fe3+>SO42-.
(5)实验反思
①实验操作V的目的是将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气.
②实验操作Ⅲ,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+.
③有同学认为装置中的空气会干扰实验结论的得出,应在实验前通一段时间的氮气.你是否同意该看法,理由是不同意,
a.实验Ⅰ中溶液变棕色,有NO生成,说明硝酸氧化Fe2+:氧化性NO3->Fe3+;
b.实验Ⅳ中溶液中检出Fe2+,说明二氧化硫还原了Fe3+:氧化性Fe3+>SO42-;
与装置中是否有氧气无关..
| A. | CH3COO- | B. | SO42-,CO32- | C. | CH3COO-SO42- | D. | SO42- |
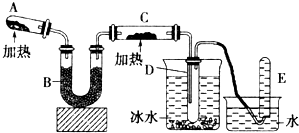 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.