题目内容
3.室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是( )| A. | 再加入10mL pH=11 NaOH溶液,混合液pH=7 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中导电粒子的数目增加,导电性增强 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$不变 |
分析 根据醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系、酸碱混合时pH的计算来解答.
解答 解:A.等体积10mL pH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则混合液的pH<7,故A错误;
B.加水稀释时,溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故B错误;
C.因醋酸溶液中加水稀释,促进电离,则液中导电粒子的数目增多,但离子浓度减小,导电性减弱,故C错误;
D、$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•(O{H}^{-})}$•$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{a}}{{K}_{W}}$,温度不变,Ka、Kw都不变,则该比值不变,故D正确;
故选D.
点评 本题考查弱电解质的电离及其影响,题目难度中等,明确稀释中溶液体积的变化与离子的物质的量的变化情况为解答本题的关键,注意掌握弱电解质的电离平衡及其影响.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
18.25℃,浓度都是1mol/L的四种正盐溶液,其pH情况如下:
(1)AY溶液pH>7 (填“>”、“<”或“=”);
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX>HY;若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH<BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=1mol/L;
在AY溶液中:c(A+)-c(Y-)=c(HY)(用一项表示)=c(OH-)-c(H+)(用两项表示);
(4)A2Z的水解方程式是Z2-+H2O?HZ-+OH-;HZ-+H2O?H2Z+OH-.
| AX | BX | AY | BY |
| pH=7,c(X-)=1mol/L | pH=4 | pH=6 |
(2)将等浓度的HX、HY稀释相同的倍数,溶液的pH变化幅度:HX>HY;若将等体积、等pH的AOH、BOH溶液在稀释时pH均下降2,则加水量:AOH<BOH(均填“>”、“<”或“=”);
(3)在BX溶液中:c(B+)+c(H+)-c(OH-)=1mol/L;
在AY溶液中:c(A+)-c(Y-)=c(HY)(用一项表示)=c(OH-)-c(H+)(用两项表示);
(4)A2Z的水解方程式是Z2-+H2O?HZ-+OH-;HZ-+H2O?H2Z+OH-.
15.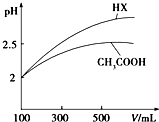 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.Na2CO3 c.NaClO
pH由小到大排列的顺序是a<c<b(用编号填写).
(2)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.稀释后,HX溶液中水电离出来的C(H+)大于(填“大于”、“小于”或“等于”)醋酸溶液中水电离出来的C(H+).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的三种溶液:a.CH3COONa b.Na2CO3 c.NaClO
pH由小到大排列的顺序是a<c<b(用编号填写).
(2)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.稀释后,HX溶液中水电离出来的C(H+)大于(填“大于”、“小于”或“等于”)醋酸溶液中水电离出来的C(H+).
12.下列说法不正确的是( )
| A. | 二氧化硫可用作一些食品的杀菌剂 | |
| B. | 明矾[KAl(SO4)2•12H2O]既可用做净水剂,也可用作消毒剂 | |
| C. | 浓硫酸、浓硝酸均具有强氧化性,常温下均可用铝制容器盛放 | |
| D. | NH4HCO3受热易分解放出NH3和CO2,可用作制作糕点时的发酵剂、膨松剂 |
 溴主要以Br-形式存在于海水中,海水呈弱碱性.工业上制备的Br2的操作步骤为:
溴主要以Br-形式存在于海水中,海水呈弱碱性.工业上制备的Br2的操作步骤为: 已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应. 实验室通常用浓硫酸和乙醇反应来制取乙烯,常因温度过高而生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫,试回答下列问题.
实验室通常用浓硫酸和乙醇反应来制取乙烯,常因温度过高而生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫,试回答下列问题.