题目内容
将0.2mol下列烃完全燃烧后,生成的气体缓缓通过0.5L 2mol/L的NaOH溶液中,生成正盐和酸式盐的物质的量之比为1:3,则该烷烃是( )
| A、乙烷 | B、丙烷 | C、丁烷 | D、戊烷 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:正盐为碳酸钠、酸式盐为碳酸氢钠,根据钠原子守恒计算出碳酸钠、碳酸氢钠的物质的量,再根据C原子守恒计算出生成二氧化碳的物质的量,然后根据烃的物质的量、二氧化碳的物质的量可确定该烷烃的分子式.
解答:
解:设Na2CO3物质的量为xmol,NaHCO3物质的量为3xmol,
由Na元素守恒得:n(Na+)=n(NaOH)=n(NaHCO3)+2n(Na2CO3),即:2x+3x=0.5L×2mol/L=1mol,
解得:x=0.2 mol,
由C元素守恒得:n(CO2)=x+3x=0.8 mol,
CnH2n+2~nCO2
1 n
0.2 mol 0.8 mol
n=
=4,
该烷烃分子中含有4个C,为丁烷,
故选C.
由Na元素守恒得:n(Na+)=n(NaOH)=n(NaHCO3)+2n(Na2CO3),即:2x+3x=0.5L×2mol/L=1mol,
解得:x=0.2 mol,
由C元素守恒得:n(CO2)=x+3x=0.8 mol,
CnH2n+2~nCO2
1 n
0.2 mol 0.8 mol
n=
| 0.8mol×1 |
| 0.2mol |
该烷烃分子中含有4个C,为丁烷,
故选C.
点评:本题考查烃燃烧的有关计算,题目难度中等,注意掌握确定有机物分子式的方法,本题采取守恒计算,简化计算,注意守恒思想在计算中的运用.

练习册系列答案
相关题目
某研究小组开展课外研究发现,将适量Zn与一定浓度氯化铁溶液反应,开始可以观察到大量气泡产生.反应后期,溶液的pH升高到6左右,金属表面出现黑色粉末,溶液变成浅绿色.试管底部出现灰绿色悬浮物.收集少量黑色粉末与稀硫酸作用有气泡产生.则下列反应没有发生的是( )
| A、FeCl3+3H2O═Fe(OH)3↓+3HCl |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、3Zn+2FeCl3═3ZnCl2+2Fe |
| D、4Fe(OH)2+O2+2H2O═4Fe(OH)3 |
用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、1L 1mol?L-1FeCl3溶液中Fe3+的数目小于NA |
| C、在18g 18O2中含有NA个氧原子 |
| D、22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
下列关于溶液的说法正确的是( )
| A、1L 0.2mol/L CaCl2溶液中,Cl-数目约为0.2×6.02×1023个 |
| B、50mL 1mol/L AlCl3溶液与100mL 3mol/L KClO3溶液中的Cl-物质的量浓度相等 |
| C、0.5L 1mol/L MgCl2溶液与0.2L 1mol/L KCl溶液中的Cl-的数目之比为5:2 |
| D、在100mL Na2SO4和KNO3的混合溶液中,Na+的物质的量浓度与SO42-的物质的量浓度之比为2:1 |
完全燃烧2mol某有机物,生成4mol CO2和6mol H2O,同时消耗5mol O2,该有机物的分子式为( )
| A、C2H6O2 |
| B、C2H4O |
| C、C2H6O |
| D、C2H6 |
在高中我们将从元素原子得失电子的角度来认识氧化还原反应,而元素原子得失电子表现为元素化合价的变化.因此可以把元素化合价有升降的化学反应确定为氧化还原反应,据此可判断下列化学反应不属于氧化还原反应的是( )
| A、Zn+CuSO4=ZnSO4+Cu | ||||
B、CuO+CO
| ||||
| C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ | ||||
D、2KClO3
|
下列推断正确的是( )
| A、SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 |
| B、新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
| C、CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D、Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同 |
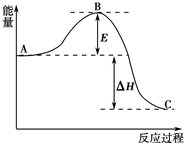 2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.
2SO2(g)+O2(g)?2SO3(g),反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.