题目内容
18.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).则下列说法正确的是( )| A. | .电池工作时,MnO2发生还原反应 | |
| B. | .电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- | |
| C. | .电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g | |
| D. | 电池工作时,K+移向负极 |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答 解:A.根据总反应可知,MnO2中Mn元素的化合价降低,发生还原反应,故A正确;
B.负极Zn失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故B错误;
C.由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故C正确;
D.电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K+、H+向正极移动,OH-向负极移动,故D错误.
故选AC.
点评 本题考查化学电源的工作原理,题目难度不大,注意电极反应方程式的书写和原电池正负极的判断.理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.

练习册系列答案
相关题目
8.已知25℃、101kPa下,下列反应
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
C(石墨)+O2(g)═CO2(g),燃烧1mol C(石墨)放热393.51kJ.
C(金刚石)+O2(g)═CO2(g),燃烧1mol C(金刚石)放热395.41kJ.
可以得出的结论是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1 mol石墨所具有的能量比1 mol金刚石低 | |
| C. | 金刚石转变成石墨是物理变化 | |
| D. | 石墨和金刚石都是碳的同位素 |
9.请根据下面信息,判断下列叙述中正确的是( )

| A. | 1mol H2O 分解为H2与O2需吸收930 kJ热量 | |
| B. | H与O反应生成1mol H2O放出930 kJ热量 | |
| C. | 2 mol H的能量小于1mol H2的能量 | |
| D. | H结合成H2放出436 kJ的热量 |
6.下列物质具有固定熔沸点的是( )
| A. | 钢化玻璃 | B. | 漂白粉 | C. | 消石灰 | D. | 水玻璃 |
13.化学与人类生产,生活密切相关.下列有关说法正确的是( )
| A. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 食用油和人造奶油都是油酸甘油酯 | |
| C. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| D. | 鸡蛋清中加入胆矾可以使蛋白质发生盐析 |
3.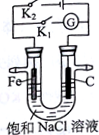 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
 如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )
如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中.下列叙述正确的是( )| A. | K1闭合,向铁棒附近滴入K3[Fe(CN)6]溶液,有蓝色沉淀出现 | |
| B. | K1闭合,电流方向由铁棒经导线流向石墨棒 | |
| C. | K2闭合,碳棒是阴极 | |
| D. | K2闭合,电路中通过0.2NA个电子时,两极共产生4.48L气体 |
10.下列物质之间的转化,不能一步实现的是( )
| A. | Na2O→NaOH | B. | NaHCO3→Na2CO3 | C. | SiO2→H2SiO3 | D. | NH3→NO |
8.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HC1 | B. | 2CH3CH2OH+02$\stackrel{Cu、△}{→}$2CH3CH0+2H20 | ||
| C. | 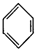 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$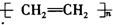 |
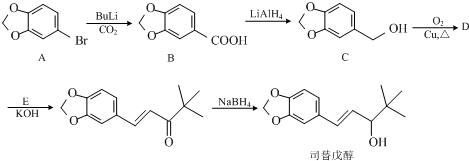
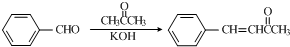
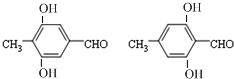 (任意一种);.
(任意一种);.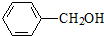 为原料制备
为原料制备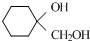 的反应合成路线流程图(无机试剂任用).
的反应合成路线流程图(无机试剂任用).