题目内容
9.请根据下面信息,判断下列叙述中正确的是( )
| A. | 1mol H2O 分解为H2与O2需吸收930 kJ热量 | |
| B. | H与O反应生成1mol H2O放出930 kJ热量 | |
| C. | 2 mol H的能量小于1mol H2的能量 | |
| D. | H结合成H2放出436 kJ的热量 |
分析 依据反应的热效应=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ;所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,据此分析.
解答 解:A、据反应方程式H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol可知,分解1mol水需要吸收245KJ的能量,故A错误;
B、据图示可知2H与O生成1mol水时放热930KJ,故B正确;
C、1molH2生成2molH吸收436KJ能量,2molH的能量比1molH2能量高,故C错误;
D、1molH2生成2molH吸收436KJ能量,反之,2molH结合生成1molH2放出436KJ能量,但此题为说明物质的量关系,故D错误.
故选:B.
点评 本题考查了反应的热效应的计算依据和判断方法,反应的实质是拆化学键吸收热量,形成化学键放出热量,主要是依据化学键的键能来计算判断吸热反应和放热反应,关键是反应的热效应的计算是用反应物的键能之和减去生成物的键能之和.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.以NA表示阿佛加德罗常数,下列说法正确的是( )
| A. | 32gO2和32gO3的质子数均为16NA | |
| B. | 23gNa与O2在加热条件充分反应,O2得到的电子数为2NA | |
| C. | 在标准状况下,22.4LSO3所含分子数为NA | |
| D. | 2 L1mol•L-1的HC1溶液中,含有的HC1分子数目为2NA |
17.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
14.如图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是( )

| A. | 1个乙分子中含有3个A原子 | B. | 该反应类型是分解反应 | ||
| C. | 反应生成的丙物质属于单质 | D. | 化学反应中分子的种类发生了改变 |
1.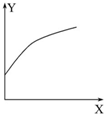 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
 在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )| X | Y | |
| A | 再加入A | B的转化率 |
| B | 降低温度 | 混合气体的密度 |
| C | 增大压强 | A的转化率 |
| D | 升高温度 | 混合气体的平均摩尔质量 |
| A. | A | B. | B | C. | C | D. | D |
18.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).则下列说法正确的是( )
| A. | .电池工作时,MnO2发生还原反应 | |
| B. | .电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- | |
| C. | .电池工作时,电路中每通过0.2mol电子,锌的质量理论上减少6.5g | |
| D. | 电池工作时,K+移向负极 |

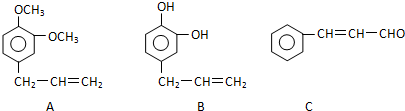
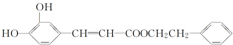 )是一种天然抗癌药物.在一定条件下能发生如下转化.
)是一种天然抗癌药物.在一定条件下能发生如下转化.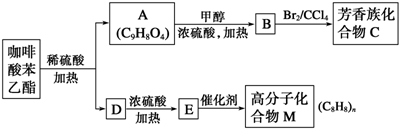
 .
. .
.
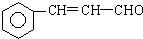 +5H2$\stackrel{一定条件下}{→}$
+5H2$\stackrel{一定条件下}{→}$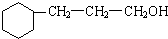 .
.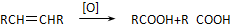 写出C在强氧化剂条件下生成的有机化合物的结构简式
写出C在强氧化剂条件下生成的有机化合物的结构简式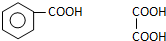 .
. .
.