题目内容
1.用下列方法均可制得氯气:①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
分析 制取的氯气质量相等,则制取的氯气物质的量相等,假设制取的氯气都是1mol,根据氯气和转移电子之间关系式计算转移电子数之比.
解答 解:制取的氯气质量相等,则制取的氯气物质的量相等,假设制取的氯气都是1mol,
①中生成1mol氯气转移电子物质的量=1mol×2×[0-(-1)]=2mol;
②中生成1mol氯气转移电子物质的量=$\frac{5mol}{3mol}×1mol$=$\frac{5}{3}$mol;
③中生成1mol氯气转移电子物质的量=$\frac{10mol}{5mol}×1mol$=2mol;
则三个方程式中转移电子物质的量之比=2mol:$\frac{5}{3}$mol:2mol=6:5:6,故选A.
点评 本题考查氧化还原反应有关计算,为高频考点,明确氯气和转移电子关系即可解答,注意②中氯气一部分来自于氯酸根离子,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.向紫色石蕊中加入过量的Na2O2粉末,震荡,可观察到的现象为( )
| A. | 溶液仍为紫色 | |
| B. | 溶液中有气泡产生,溶液最终变为无色 | |
| C. | 最终溶液褪色,而无其他现象 | |
| D. | 溶液最终变为蓝色 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
16.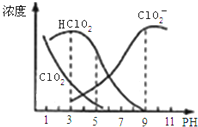 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在酸性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
18.在20℃时的密闭容器中,加入0.1mol/L的N2O4,经过一段时间后,测定反应体系中各物质的浓度,数据如表.
请根据反应的化学方程式N2O4?2NO2分析:
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) mol/L | 0.100 | 0.070 | 0.050 | 0.040 | 0.040 | 0.040 |
| c(NO2) mol/L | 0.000 | 0.060 | 0.100 | 0.120 | 0.120 | 0.120 |
①反应处于平衡状态的时间是60s、80s、100s.当其他条件不变,时间为120秒时,c(NO2)=0.120mol/L.
②反应开始至60秒时,平均速率υ(N2O4 )=0.001mol/(L•s).
③对此平衡体系降低温度后,气体的颜色变浅,则正反应是吸热(填“放热”或“吸热”)反应.
④若在此反应中加入适宜的催化剂,对化学反应速率影响(填“影响”或“不影响”),对化学平衡不影响(填“影响”或“不影响”).
19.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,5.6 L四氯化碳(CCl4)含有的分子数为0.25NA | |
| D. | NA个一氧化碳分子和0.5 mol 甲烷的质量比为7:4 |
 已知:CH3CH2OH+NaBr+H2SO4(浓) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓) $\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.