题目内容
6.称取一小块切割后的金属钠样品10.8g,实验测得Na元素的含量为85.2%,求样品中所含氧化钠的质量.分析 钠元素含量为85.2%,则钠元素质量=10.8g×85.2%=9.2g,则氧元素质量=10.8g-9.2g=1.6g,
则n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,根据O原子守恒得n(Na2O)=n(O)=0.1mol,则m(Na2O)=n(Na2O)M(Na2O).
解答 解:钠元素含量为85.2%,则钠元素质量=10.8g×85.2%=9.2g,则氧元素质量=10.8g-9.2g=1.6g,
则n(O)=$\frac{1.6g}{16g/mol}$=0.1mol,根据O原子守恒得n(Na2O)=n(O)=0.1mol,则m(Na2O)=n(Na2O)M(Na2O)=0.1mol×62g/mol=6.2g,
答:样品中氧化钠的质量是6.2g.
点评 本题考查物质的量的有关计算,为高频考点,明确物质的量公式中各个物理量的关系即可解答,注意原子守恒的灵活运用.

练习册系列答案
相关题目
17.下列有关离子检验的操作和实验结论都正确的是
( )
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
14.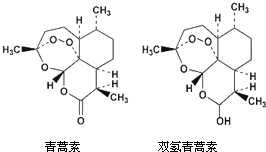 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )| A. | 青蒿素和双氢青蒿素互为同分异构体 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素的分子式为C15H22O5 | |
| D. | 青蒿素分子中含有过氧链和酯基、醚键 |
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
6.下列物质的制备方法正确的是( )
| A. | 氯化铝溶液和硫化钠溶液反应制备Al2S3 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 用铝粉和MnO2制得锰 | |
| D. | 电解熔融氯化铝的方法制得单质铝 |

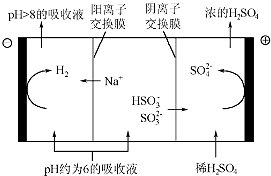 硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.
硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3△H=-47kJ/mol.