题目内容
12.向紫色石蕊中加入过量的Na2O2粉末,震荡,可观察到的现象为( )| A. | 溶液仍为紫色 | |
| B. | 溶液中有气泡产生,溶液最终变为无色 | |
| C. | 最终溶液褪色,而无其他现象 | |
| D. | 溶液最终变为蓝色 |
分析 过氧化钠与水反应生成NaOH和氧气,并且Na2O2具有强氧化性,能使紫色溶液褪色.
解答 解:过氧化钠与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,溶液中有气泡产生,过氧化钠过量,且有强氧化性,能使紫色石蕊溶液因氧化而褪色,溶液最终变为无色.
故选B.
点评 本题考查过氧化钠的性质,题目难度不大,注意过氧化钠能使紫色溶液褪色的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等.下列反应与Br2+SO2+2H2O=H2SO2+2HBr相比较,水的作用相同的是( )
| A. | 电解水:2H20═2H2↑+O2↑ | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2F2+H2O═4HF+O2 | D. | 3NO2+H2O═2HNO3+NO |
3.普通玻璃的主要成分是( )
①Na2SiO3②CaCO3③CaSiO3④SiO2⑤Na2CO3.
①Na2SiO3②CaCO3③CaSiO3④SiO2⑤Na2CO3.
| A. | ①③⑤ | B. | ②③④ | C. | ①③④ | D. | ③④⑤ |
20.下列有关金属腐蚀的叙述正确的是( )
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
7.下列不属于自发进行的变化是( )
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
17.下列有关离子检验的操作和实验结论都正确的是
( )
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
10.在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)$?_{△}^{催化剂}$2SO3(g)△H=-92.3KJ/mol 0~4min时,容器内气体压强为101KPa,反应过程中,SO2、O2、SO3的物质的量n (mol)的变化如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:
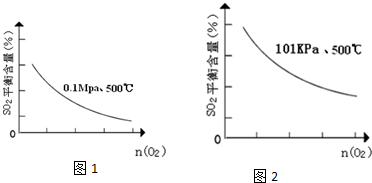
在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
(1)该反应的化学平衡常数表达式是K=$\frac{{c}^{2}(S{O}_{2})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$.
(2)在3min-4min及7min-9min时间段,反应处于平衡状态.
(3)计算:0~3min时间内,用SO2表示该反应的平均反应速率是0.08mol/min,7min时,SO2的转化率为30%.
(4)第5min时,从速率和转化率两个方面分析,改变的外界条件是增大压强;平衡向正反应方向移动.
(5)在101Kpa、500℃时,O2的物质的量与SO2平衡时的体积百分含量的变化曲线如图1:

在图中2画出在相同压强下,温度为400℃时,起始O2的物质的量与SO2平衡时的体积百分含量的大致变化曲线.