题目内容
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数为3NA | |
| B. | 3.9gNa2O2晶体中阴阳离子总数为0.15NA | |
| C. | 25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
分析 A、NaNO3水溶液中有水存在;
B、过氧化钠中含有2个钠离子和1个过氧根离子,阴阳离子总数为3个;
C、溶液体积不明确;
D、羟基不带电荷,氢氧根带一个负电荷.
解答 解:A、NaNO3水溶液中有水存在,故1.0L1.0mo1•L-1的NaNO3水溶液中含有的氧原子数大于3NA,故A错误;
B、3.9gNa2O2晶体的物质的量为$\frac{3.9g}{78g/mol}$=0.05mol,故阴阳离子总数为0.05mol×3=0.15mol,即0.15NA个,故B正确;
C、Ba(OH)2溶液的体积不知,故无法计算OH-的物质的量,故C错误;
D、羟基不带电荷,故1mol-OH含9mol电子;1mol氢氧根含10mol电子即10NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.恒温恒压的密闭容器中发生反应A(g)+2B(g)?3C(g),能说明反应达到平衡状态的是( )
| A. | 容器内的压强不再变化 | |
| B. | 混合气体的密度不再变化 | |
| C. | 单位时间消耗2molA,同时消耗6molC | |
| D. | 混合气体的平均相对分子质量不再变化 |
20.下列有关金属腐蚀的叙述正确的是( )
| A. | 金属越纯越不易被腐蚀 | |
| B. | 干燥环境下金属不被腐蚀 | |
| C. | 铜一定比铁难腐蚀 | |
| D. | 金属的腐蚀有化学腐蚀和电化学腐蚀 |
17.下列有关离子检验的操作和实验结论都正确的是
( )
| 选项 | 实验操作现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶液 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中滴入硝酸酸化硝酸银溶液产生白色沉淀 | 该溶液中一定含有Cl- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的五色气体 | 该溶液中一定含有CO${\;}_{3}^{2-}$ |
| D | 向某溶液中加入氯化钡溶液,产生白色沉淀,生成白色沉淀,将沉淀过滤后,在沉淀中加入稀盐酸,沉淀部分溶解,并产生无色无味能使澄清石灰水变浑浊的气体 | 该溶液中既有CO${\;}_{3}^{2-}$又有SO${\;}_{4}^{2-}$ |
| A. | A | B. | B | C. | C | D. | D |
14.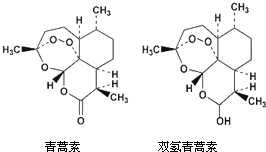 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
 85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”下列关于青蒿素和双氢青蒿素(结构如图),下列说法错误的是( )| A. | 青蒿素和双氢青蒿素互为同分异构体 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素的分子式为C15H22O5 | |
| D. | 青蒿素分子中含有过氧链和酯基、醚键 |
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
6.下列物质的制备方法正确的是( )
| A. | 氯化铝溶液和硫化钠溶液反应制备Al2S3 | |
| B. | 用镁粉和空气反应制备Mg3N2 | |
| C. | 用铝粉和MnO2制得锰 | |
| D. | 电解熔融氯化铝的方法制得单质铝 |
7.以下实验原理或操作中,正确的是( )
| A. | 用NaOH溶液滴定盐酸,滴定前尖嘴下端有气泡,滴定后气泡消失,会使结果偏高 | |
| B. | 仰视量筒刻度量取一定量浓硫酸所配制的0.10 mol•L-1 H2SO4溶液的浓度结果偏低 | |
| C. | 焰色反应实验中,铂丝在蘸取待测溶液前应先用稀硫酸洗净并灼烧至无色 | |
| D. | 要将溶解在CCl4中的碘分离出来,以用蒸馏法,因为碘易升华,先分离出来 |