题目内容
16.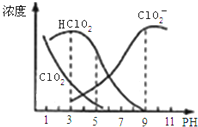 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析正确的是( )| A. | 亚氯酸钠在酸性条件下较稳定 | |
| B. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| C. | pH越大,该漂白剂的漂白性能越好 | |
| D. | 25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-) |
分析 A、由图可以得出:碱性条件下ClO2-浓度高;
B、HClO2的电离平衡常数K=$\frac{c(Cl{{O}_{2}}^{-})•c({H}^{+})}{c(HCl{O}_{2})}$结合图示数据来计算;
C、根据题意:HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度大小来确定使用该漂白剂的最佳pH;
D、依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),依据物料守恒得出:2c(Na+)=c(ClO2-)+c(HClO2),据此解答即可.
解答 解:A、由图可以得出:碱性条件下ClO2-浓度高,即在碱性条件下亚氯酸钠较稳定,故A错误;
B、HClO2的电离平衡常数K=$\frac{c(Cl{{O}_{2}}^{-})•c({H}^{+})}{c(HCl{O}_{2})}$,观察图象可以看出,当pH=6时,c(ClO2-)=c(HClO2),因此HClO2的电离平衡常数的数值Ka=10-6,故B正确;
C、HClO2和ClO2都具有漂白作用,结合图中HClO2和ClO2的浓度越大即为使用该漂白剂的最佳pH,应该是4-5,故C错误;
D、若没有氯离子,依据电中性原则得出:c(H+)+c(Na+)=c(ClO2-)+c(OH-),但溶液中含有氯离子其浓度变化没有画出,故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断,题目难度稍大,正确分析、理解题中信息及图象数据是解答本题关键,注意明确溶液酸碱性与溶液pH的关系.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
7.下列不属于自发进行的变化是( )
| A. | 红墨水加到清水使整杯水变红 | B. | 冰在室温下融化成水 | ||
| C. | 铁器在潮湿的空气中生锈 | D. | NaHCO3转化为Na2CO3 |
11.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- | |
| D. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- |
1.用下列方法均可制得氯气:
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
①MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
| A. | 6:5:6 | B. | 1:3:5 | C. | 15:5:3 | D. | 1:6:10 |
13.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸.反应原理:
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
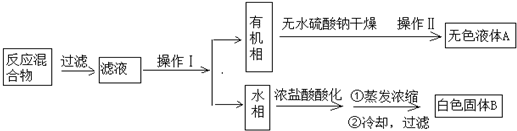
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
(4)纯度测定:称取1.220g产品,配成100mL甲醇溶液,移取25.00mL溶液,与一定量KOH溶液恰好完全反应,消耗KOH的物质的量为2.40×10-3 mol.产品中苯甲酸的质量分数为96%.
-CH3+2KMnO4$\stackrel{△}{→}$-COOK+KOH+2MnO2↓+H2O
-COOK+HCl→-COOH+KCl
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物一般都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是溶液颜色褪去.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔.该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确,请完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中, 加热溶解,冷却结晶、过滤 | 得到白色晶体和无色溶液 | 无 |
| ② | 取少量滤液于试管中, 滴入稀HNO3和AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,测定熔点 | 白色晶体在122.4℃左右完全熔化 | 白色晶体是苯甲酸 |