题目内容
8.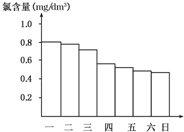 某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )
某校化学研究性学习小组对日常生活中的氯气的用途进行了调查,在调查某室外游泳池夏季池水消毒情况时,得知该游泳池每周一上午8:00换水,然后通入氯气消毒,如图是该小组每天19:00时测定的游泳池中水的含氯量,由此推测天气炎热、阳光强烈最可能的一天是( )| A. | 周一 | B. | 周二 | C. | 周三 | D. | 周四 |
分析 因为HClO又有光照易分解的性质:2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,使ClO-浓度降低,有效氯降低,杀菌消毒效果不理想.看纵坐标每天的变化量,可见周四、周六下降幅度明显,因此阳光强烈.
解答 解:因为阳光强烈时HClO更易分解,致含氯量下降明显,所以导致星期四、星期六的含氯量下降明显,故选D.
点评 本题以氯水中HClO的性质为考查对象设置题目,答本题要把图中信息和化学知识有机地结合起来进行分析、判断,从而得出正确的结论,题目难度不大.

练习册系列答案
相关题目
18.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 0.5 mol苯分子中含有C=C双键数目为1.5 NA | |
| B. | 常温常压下,17 g 羟基含有的电子总数为9NA | |
| C. | 标准状况下,11.2 L CHCl3 中含有的共价键数目为2NA | |
| D. | 将1 mol蔗糖与稀H2SO4混合使之完全水解,可生成2NA个葡萄糖分子 |
19.下表列出了①~⑩十种元素在周期表中的位置:
(1)上述①~⑩十种元素中(用元素符号填空):构成有机物的主要元素是C,构成岩石与许多矿物的基本元素是Si,化学性质最不活泼的元素是Ar,气态氢化物的水溶液呈碱性的元素是N.
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑩ | |
| 4 | ⑨ |
(2)上述①~⑨元素的最高价氧化物对应的水化物中:碱性最强的物质的化学式为NaOH.
(3)若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作正极(填“正”或“负”)
(4)元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体.若这两种气体混合,会生成一种淡黄色粉末.此反应化学方程式为2H2S+SO2=3S↓+2H2O.若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为1.204×1023(填数值).
(5)元素⑧和元素⑨两者核电荷数之差是18,这两种元素中非金属性较弱的元素是溴(填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)Cl2+2Br-=2Cl-+Br2.
16.下列关于同分异构体的说法正确的是( )
| A. | 分子式和结构都相同,性质可能相同 | |
| B. | 分子式相同,结构不同,化学性质一定不相同 | |
| C. | 相对分子质量一定相同、官能团一定不同 | |
| D. | 相对分子质量和各元素质量分数一定相同,化学性质不一定相同 |
3.有①Na2CO3溶液 ②NaHCO3溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1mol.L-1,下列说法正确的是( )
| A. | 3种溶液pH的大小顺序是 ③>②>① | |
| B. | 若分别加入25mL0.1mol•L-1盐酸,反应后pH最大的是① | |
| C. | 若将3种溶液稀释相同倍数,pH变化最大的是② | |
| D. | 若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
13.由乙烯推测丙烯(CH3CH=CH2)的结构或性质正确的是( )
| A. | 分子中3个碳原子在同一直线上 | B. | 分子中所有原子在同一平面上 | ||
| C. | 与氯化氢加成只生成一种产物 | D. | 能发生加聚反应 |
20.在1100℃,一定容积的密闭容器中发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=a kJ/mol(a>0),该温度下K=0.263,下列有关该反应的说法正确的是( )
| A. | 若生成1 mol Fe,则吸收的热量小于a kJ | |
| B. | 若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 | |
| C. | 若升高温度,正反应速率加快,逆反应速率减慢,则化学平衡正向移动 | |
| D. | 达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
17.下列表示物质结构的化学用语正确的是( )
| A. | 8个中子的碳原子的核素符号:14C | B. | HF的电子式: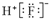 | ||
| C. | Cl-离子的结构示意图: | D. | 氧化铝的化学式:AlO |
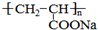 )是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图:
)是一种强吸水树脂.由某烃A合成聚丙烯酸钠的流程如图: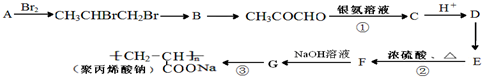
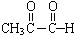 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$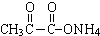 +3NH3+2Ag↓+H2O.
+3NH3+2Ag↓+H2O.