题目内容
5.如图是一套制取并验证氯气部分化学性质的实验装置.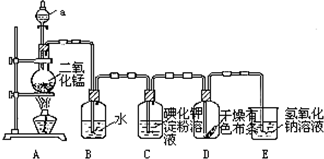
回答下列问题:
(1)装置A中,仪器a的名称叫分液漏斗,该仪器中盛有的试剂为浓盐酸;
(2)装置B的作用是湿润氯气,当氯气通过一段时间后,B中溶液的pH<(填“>”“<”或“=”)7;
(3)当有少量Cl2通过后,观察到装置C中溶液变成蓝色;
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么?能,因为湿润的氯气有漂白性.
(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有浓硫酸的洗气瓶;
(6)装置E的作用是吸收多余的氯气,该反应的离子方程式为Cl2+2OH-=Cl-++ClO-+H2O.
分析 (1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸溶液呈酸性;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质遇到淀粉变蓝;
(4)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸;
(5)若要证明Cl2无漂白性,需在CD之间加一个装有浓硫酸的洗气瓶;
(6)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收.
解答 解:(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
故答案为:分液漏斗;浓盐酸;
(2)氯气通过B瓶,能够湿润氯气,氯气既溶解于水又和水反应生成盐酸和次氯酸,反应化学方程式为:Cl2+H2O═HCl+HClO,溶液呈酸性,溶液PH小于7;
故答案为:湿润氯气;<;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,反应离子方程式为:Cl2+2I -=2Cl-+I2,碘单质遇到淀粉变蓝;
故答案为:蓝;
(4)湿润的氯气遇到干燥的有色布条能褪色,起漂白作用的是次氯酸,能使干燥的有色布条褪色;
故答案为:能,因为湿润的氯气有漂白性;
(5)若要证明Cl2无漂白性,需在CD之间加一个装有浓硫酸的洗气瓶,故答案为:浓硫酸;
(6)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的离子方程式为Cl2+2OH-=Cl-++ClO-+H2O;
故答案为:吸收多余的氯气;Cl2+2OH-=Cl-++ClO-+H2O.
点评 本题考查了实验室制备氯气的实验装置分析判断,性质实验验证,反应现象和性质掌握是解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.已知A是组成有机物的必须元素,元素B~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.
(1)已知E在B的单质中燃烧生成淡黄色的固体,该固体化合物的电子式为 .
.
(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
16.下列热化学方程式中,正确的是( )
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ•mol -1 | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
13.常温下0.1mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
| A. | 将溶液稀释到原体积的10倍 | B. | 加入适量的醋酸钠固体 | ||
| C. | 加入等体积0.2mol/L盐酸 | D. | 提高溶液的温度 |
10.下列反应能够瞬间完成的是( )
| A. | 硝酸与铜的反应 | B. | HNO3(aq)与NaOH(aq)的反应 | ||
| C. | 光照H2与O2的混合物 | D. | 铜绿的生成 |
15.下列有关仪器的使用方法或实验操作正确的是( )
| A. | 将FeCl3溶液直接蒸干制取无水FeCl3固体 | |
| B. | 配制CuSO4溶液时,需加入少量的稀硫酸以抑制Cu2+水解 | |
| C. | 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 用广泛pH试纸测定溶液pH时,试纸需预先用蒸馏水湿润 |
16.下列物质能导电的是( )
| A. | 氯化氢气体 | B. | 无水酒精 | C. | 熔融的氯化钠 | D. | 硫酸铜晶体 |
