题目内容
16.下列物质能导电的是( )| A. | 氯化氢气体 | B. | 无水酒精 | C. | 熔融的氯化钠 | D. | 硫酸铜晶体 |
分析 存在自由移动的离子或电子,则物质就能导电,据此判断即可.
解答 解:A、氯化氢为共价化合物,氯化氢气体中不存在自由移动的离子,不能导电,故A错误;
B、无水酒精不能电离出自由移动的离子,不能导电,故B错误;
C、熔融的氯化钠中存在自由移动的钠离子和氯离子,能导电,故C正确;
D、硫酸铜晶体中不存在自由移动的离子,不能导电,故D错误,故选C.
点评 本题主要考查的是能导电的物质,金属,存在自由移动的电子能导电;产生自由移动电子的溶液或熔融状态下电离的物质能导电,难度不大.

练习册系列答案
相关题目
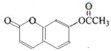
7.有关如图所示化合物的说法不正确的是( )


| A. | 既可以加成反应,又可以发生取代反应 | |
| B. | 1mol该化合物最多可以与5mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
11.元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法错误的是( )
| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
1.某同学欲配制含下列不同阴、阳离子的混合溶液,其中能配制成功的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Ba2+、Na+、SO42-、Cl- | ||
| C. | NH4+、I-、K+、OH- | D. | Cu2+、Na+、S2-、SO42- |
6.如表实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
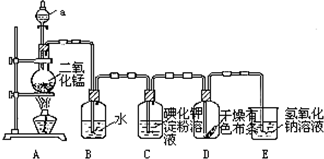
 .
. .
.