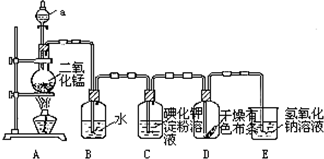
题目内容
15.已知A是组成有机物的必须元素,元素B~E表示元素周期表中短周期的四种元素,请根据表中信息回答下列问题.| 元素 | 性质或结构信息 |
| B | 原子最外层电子数是电子层数的3倍. |
| C | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍. |
| D | 单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里. |
| E | 最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子. |
 .
.(2)C的氢化物和C的最高价氧化物的水化物反应生成甲,甲是共价化合物还是离子化合物?离子化合物,甲中的化学键类型为离子键和共价键.
(3)请写出 A的单质与D的最高价含氧酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
分析 已知A是组成有机物的必须元素,则A为C元素;B的原子最外层电子数是电子层数的3倍,则B只能位于第二周期,最外层含有6个电子,B为O元素;工业上通过分离液态空气获得C的单质,由于B为O元素,则该单质只能为氮气,N原子的最外层电子数是内层电子总数的2.5倍;D的单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里,则D为S元素;E最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子,结合(1)E在B的单质中燃烧生成淡黄色的固体,则E为Na元素,据此进行解答.
解答 解:已知A是组成有机物的必须元素,则A为C元素;B的原子最外层电子数是电子层数的3倍,则B只能位于第二周期,最外层含有6个电子,B为O元素;工业上通过分离液态空气获得C的单质,由于B为O元素,则该单质只能为氮气,N原子的最外层电子数是内层电子总数的2.5倍,则C为N元素;D的单质是黄色晶体,不溶于水,微溶于酒精,易溶于二硫化碳,游离态的D存在于火山喷口附近或地壳的岩层里,则D为S元素;E最高价氧化物的水化物能电离出与Ne电子数相等的阴阳离子,结合(1)E在B的单质中燃烧生成淡黄色的固体,则E为Na元素,
(1)E在B的单质中燃烧生成淡黄色的固体,该固体为过氧化钠,过氧化钠为离子化合物,其电子式为: ,
,
故答案为: ;
;
(2)C为N元素,N的氢化物为氨气、N的最高价氧化物的水化物为硝酸,氨气与硝酸反应生成硝酸铵为离子化合物,硝酸铵中含有离子键和共价键,
故答案为:离子化合物;离子键和共价键;
(3)A的单质为C,D的最高价含氧酸为硫酸,碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,注意熟练掌握元素周期表结构、元素周期律内容,试题培养了学生的分析能力及灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | FeS+HCl | B. | K2S+HCl | C. | Na2S+CH3COOH | D. | K2S+H2SO3 |
| A. | 使用催化剂可以加快反应速率,提高生产效率 | |
| B. | 适当提高O2的浓度可以提高SO2的转化率 | |
| C. | 达到平衡时,正反应速率和逆反应速率都为零 | |
| D. | 达到平衡时,SO2、O2、SO3的物质的量浓度不再变化 |

| A. | 反应开始时,甲中石墨电极上Fe3+被还原 | |
| B. | 反应开始时,乙中电极反应为2I--2e-=I2 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 平衡时甲中溶入FeCl2固体后,电流计读数为零 |
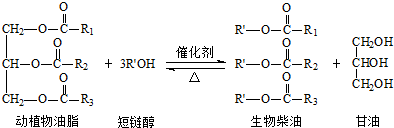
下列叙述错误的是( )
| A. | 生物柴油是不同酯组成的混合物 | B. | 动植物油脂是高分子化合物 | ||
| C. | “地沟油”可用于制备生物柴油 | D. | 生物柴油由可再生资源制得 |
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).

 C
C ;
; ;该反应类型为消去反应.
;该反应类型为消去反应.