题目内容
15.下列有关仪器的使用方法或实验操作正确的是( )| A. | 将FeCl3溶液直接蒸干制取无水FeCl3固体 | |
| B. | 配制CuSO4溶液时,需加入少量的稀硫酸以抑制Cu2+水解 | |
| C. | 酸碱中和滴定实验中,用待测溶液润洗锥形瓶以减小实验误差 | |
| D. | 用广泛pH试纸测定溶液pH时,试纸需预先用蒸馏水湿润 |
分析 A.FeCl3是强酸弱碱盐,Fe3+水解生成Fe(OH)3和HCl,升高温度促进盐酸挥发;
B.CuSO4是强酸弱碱盐,Cu2+水解Cu(OH)2而使溶液变浑浊;
C.酸碱中和滴定实验中,锥形瓶不能用待测液润洗;
D.用广泛pH试纸测定溶液pH时,试纸不能用蒸馏水事先湿润,否则易导致浓度降低.
解答 解:A.FeCl3是强酸弱碱盐,Fe3+水解生成Fe(OH)3和HCl,升高温度促进盐酸挥发,所以将FeCl3溶液直接蒸干得到Fe(OH)3固体,故A错误;
B.CuSO4是强酸弱碱盐,Cu2+水解Cu(OH)2而使溶液变浑浊,为防止铜离子水解,应该加入少量稀硫酸,故B正确;
C.酸碱中和滴定实验中,锥形瓶不能用待测液润洗,否则易导致测量结果偏大,故C错误;
D.用广泛pH试纸测定溶液pH时,试纸不能用蒸馏水事先湿润,否则易导致浓度降低,测量不准确,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理是解本题关键,涉及盐类水解、中和滴定、pH测定等知识点,侧重考查实验基本操作及原理,注意从操作规范性及物质性质方面分析解答,题目难度不大.

练习册系列答案
相关题目
4.X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种物质中的一种.下表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH.
(1)X、Z的化学式分别为NaOH、NaNO2.
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).
| 0.01mol/L的溶液 | X | Y | Z | W |
| pH | 12 | 2 | 8.5 | 4.5 |
(2)W的电离方程式是NH4NO3═NH4++NO3-.
(3)常温下,W的pH<7的原因是NH4++H2O?NH3•H2O+H+(用离子方程式表示).
(4)将浓度均为1mol/L的X、Z两种溶液各取20mL配成混合溶液,该混合溶液中各离子的浓度由大到小的顺序是c(Na+)>c(OH-)>c(NO2-)>c(H+).
10.下列各组离子能在指定环境中大量共存的是( )
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1mol•L-1 的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
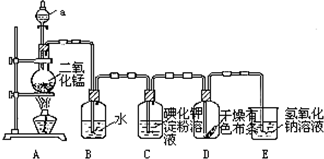
20.一种荧光氨基酸的结构简式如图所示,有关该化合物的说法正确的是( )

| A. | 分子中含有2个手性碳原子 | |
| B. | 能与强酸反应 | |
| C. | 1mol该有机物最多可与1molBr2发生反应 | |
| D. | 1mol该有机物最多可与含4molNaOH的溶液反应 |
7.有关如图所示化合物的说法不正确的是( )


| A. | 既可以加成反应,又可以发生取代反应 | |
| B. | 1mol该化合物最多可以与5mol NaOH反应 | |
| C. | 既可以催化加氢,又可以使酸性KMnO4溶液褪色 | |
| D. | 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
 .
.