题目内容
20.用铂电极电解含一定量CuSO4的电解液,一段时间后,需加入0.1mol Cu(OH)2才能使电解液的pH和浓度复原,试回答:(1)计算整个过程中转移电子的物质的量为0.4molmol;
(2)写出阴极的电极反应式Cu2++2e-=Cu,2H++2e-=H2↑;
(3)若整个电解过程以铅蓄电池为电源,此过程中消耗H2SO4的物质的量为0.4molmol.
分析 (1-2)根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,Cu(OH)2从组成上可看成CuO•H2O,所以实际上相当于加入的物质是氧化铜和水,据此分析.
(3)根据铅蓄电池放电的反应Pb+PbO2+2H2SO4=2PbSO4+2H2O,结合转移电子数相等计算.
解答 解:(1-2)加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,Cu(OH)2从组成上可看成CuO•H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,则阴极上析出氢气和铜,反应式为Cu2++2e-=Cu,2H++2e-=H2↑,生成0.1mol铜转移电子=0.1mol×2mol=0.2mol,根据原子守恒知,生成0.1mol水需要0.1mol氢气,生成0.1mol氢气转移电子=0.1mol×2mol=0.2mol,所以电解过程中共转移电子数为0.4mol,
故答案为:(1)0.4mol;(2)Cu2++2e-=Cu,2H++2e-=H2↑;
(3)因为铅蓄电池放电的反应Pb+PbO2+2H2SO4=2PbSO4+2H2O,每转移2mol电子消耗2mol硫酸,所以此过程中消耗H2SO4的物质的量为0.4mol,故答案为:0.4mol.
点评 本题考查了电解原理,根据离子放电顺序、原子守恒来分析解答,明确加入物质的性质是解本题关键,题目难度中等.

练习册系列答案
相关题目
10.工业制硫酸中的一步重要反应是SO2在400~500℃的催化氧化:2SO2+O2?2SO3,这是一个正反应放热的可逆反应,如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A. | 使用催化剂可以加快反应速率,提高生产效率 | |
| B. | 适当提高O2的浓度可以提高SO2的转化率 | |
| C. | 达到平衡时,正反应速率和逆反应速率都为零 | |
| D. | 达到平衡时,SO2、O2、SO3的物质的量浓度不再变化 |
11.下列化学用语正确的是(( )
| A. | 质子数35、中子数45的溴原子:${\;}_{35}^{80}$Br | |
| B. | CH4的球棍模型示意图为 | |
| C. | 乙烯的结构简式:CH2CH2 | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
8.下列说法正确的是( )
| A. | 水能、风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源 | |
| B. | 氯水、氨水、王水是混合物,水银、水玻璃是纯净物 | |
| C. | HCl、NH3、BaSO4是电解质,CO2、Cl2、CH3CH2OH是非电解质 | |
| D. | H、D、T属于同位素,H2、D2、T2属于同素异形体 |
10.下列各组离子能在指定环境中大量共存的是( )
| A. | 在c(HCO${\;}_{3}^{-}$)=0.1mol•L-1 的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 在由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Fe2+、ClO-、Na+、SO42- | |
| C. | pH=1的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SO42-、CO32-、Na+、K+ |
11.元素在周期表中的位置反映了元素的原子结构和元素的性质,下列说法错误的是( )
| A. | 元素周期表中位于金属与非金属分界线附近的元素,既表现金属性,又表现非金属性 | |
| B. | 同主族元素的原子,最外层电子数相同,化学性质相似 | |
| C. | 短周期元素形成离子后,最外层电子都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价都等于它的族序数 |
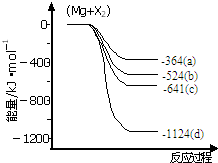 镁化合物具有广泛用途,请回答有关镁的下列问题:
镁化合物具有广泛用途,请回答有关镁的下列问题: