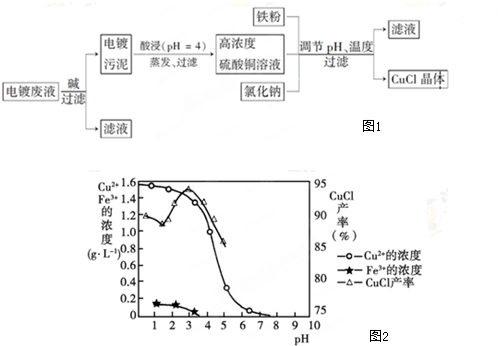
题目内容
2.聚合硫酸铁铝(PFAS)是一种新型高效水处理剂.利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下: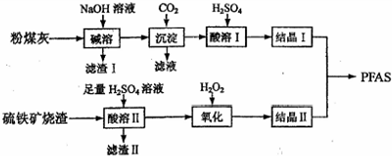
(1)“碱溶”时,Al2O3发生反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O;
(2)“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)“滤渣Ⅰ”、“滤渣Ⅱ”在本流程中能加以利用的是滤渣Ⅰ;
(4)“氧化”时应控制温度不超过57℃,其原因是温度过高,H2O2会分解;
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应的离子方程式是MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(6)酸度对絮凝效果和水质有显著影响,若产品中酸残留过多,使用时产生的不良后果是硫酸抑制Al3+和Fe3+水解,降低絮凝效果,且水的酸度增大,影响水质.
分析 粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;
硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS;
(1)加入NaOH溶液使Al2O3溶解生成偏铝酸钠和水;
(2)四氧化三铁和酸反应生成铁盐、亚铁盐、水;
(3)“滤渣Ⅰ”中含有Fe2O3、FeO,“滤渣Ⅱ”中含有SiO2,根据工艺流程,滤渣Ⅰ可加以利用;
(4)H2O2氧化Fe2+时,温度不能过高,其原因是温度过高,H2O2会分解;
(5)“氧化”时若用酸性高锰酸钾溶液代替,发生反应是酸溶液中高锰酸根离子氧化亚铁离子为铁离子,高锰酸根离子被还原为锰离子;
(6)因为Fe3+、Al3+水解均呈酸性,所以产品PFAS中硫酸残留过多,会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质.
解答 解:粉煤灰(主要成分为Al2O3、Fe2O3、FeO等),加入NaOH溶液使Al2O3溶解,其方程式为Al2O3+2NaOH=2NaAlO2+H2O,氧化铁、氧化亚铁和氢氧化钠不反应,通入过量CO2,发生的反应为CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3;再加入H2SO4时,其反应原理为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,结晶得到Al2(SO4)3晶体;
硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等),向硫铁矿烧渣中加入H2SO4,其方程式为FeO+H2SO4=FeSO4+H2O,Fe3O4+8H+=2Fe3++Fe2++4H2O,二氧化硅与硫酸不反应,加入过氧化氢氧化亚铁盐2Fe2++H2O2+2H+=2Fe3++2H2O为铁盐,结晶Ⅰ结晶Ⅱ制备PFAS;
(1)氧化铝为两性氧化物,“碱溶”时,Al2O3发生反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(2)四氧化三铁中铁$\frac{1}{3}$为+2,$\frac{2}{3}$为+3,“酸溶Ⅱ”时,Fe3O4发生反应的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)依据上述分析可知,“滤渣Ⅰ”中含有Fe2O3、FeO,“滤渣Ⅱ”中含有SiO2,根据工艺流程,滤渣Ⅰ可加以利用,故答案为:滤渣Ⅰ;
(4)过氧化氢氧化亚铁盐为铁盐,2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2氧化Fe2+时,“氧化”时应控制温度不超过57℃,其原因是温度不能过高,其原因是温度过高,H2O2会分解,故答案为:温度过高,H2O2会分解;
(5)“氧化”时若用MnO2代替H2O2,发生反应是酸溶液中高锰酸根离子氧化亚铁离子为铁离子,高锰酸根离子被还原为锰离子,Mn元素的化合价由+7降到+2,降低5价;Fe元素的化合价由+2升高到+3价,升高1价,最小公倍数为5;再根据质量守恒得到H2O的系数为4,H+的系数为8,离子反应为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(6)酸度对絮凝效果和水质有显著影响.若产品PFAS中残留过多,使用时产生的不良后果是,因为Fe3+、Al3+水解均呈酸性,所以产品PFAS中硫酸残留过多,会抑制Al3+、Fe3+水解,降低絮凝效果,并且酸度过大影响水质;
故答案为:硫酸抑制Al3+和Fe3+水解,降低絮凝效果,且水的酸度增大,影响水质.
点评 本题考查了物质制备实验工厂分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用,掌握基础是关键,题目难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 120吨 | B. | 117.6吨 | C. | 116吨 | D. | 121吨 |
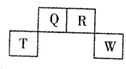
| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
①离子化合物含离子键,也可能含极性键或非极性键
②共价化合物含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物是离子化合物.
| A. | ①③⑥ | B. | ②④⑥ | C. | ②③④ | D. | ①③⑤ |
| A. | H2O、Al2Cl6 | B. | CO2、SO42- | ||
| C. | PCl5、[Co(NH3)4Cl2]Cl | D. | NH4Cl、[Cu(NH3)4]SO4 |