题目内容
13.在一定条件下的密闭器中,下列反应达到化学平衡:2HI(g)?H2(g)十I2(g)(正反应为吸热反应)(1)如果升高温度,平衡混合物的颜色加深,气体的总物质的量不变,体系的压强增大.
(2)如果加入一定量的H2,平衡逆方向移动.
(3)如果使密闭器的体积增大,平衡不移动.
分析 (1)升高温度化学平衡向着吸热方向进行;
(2)增加生成物浓度,化学平衡向着逆反应方向移动;
(3)压强对于反应前后体积不变的反应而言,不会引起化学平衡的移动.
解答 解:(1)2HI(g)?H2(g)+I2(g) (正反应为吸热反应),升高温度化学平衡向着正方向进行,生成碘蒸汽,所以颜色变深,两边的计量数相等,所以气体总物质的量不变,根据PV=nRT,升高温度P变大,体系的压强增大,故答案为:加深;不变;增大;
(2)增加生成物氢气浓度,化学平衡向着逆反应方向移动,故答案为:逆方向;
(3)该反应是反应前后体积不变的反应,使密闭容器的体积减小,即增大压强,不会引起化学平衡的移动,故答案为:不.
点评 本题考查学生化学平衡移动原理知识的应用,可以根据所学知识来回答,较简单.

练习册系列答案
相关题目
4.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 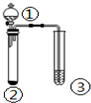 |
| A | 稀盐酸 | Na2S | 漂粉精溶液 | 酸性:盐酸>氢硫酸>次氯酸 | |
| B | 浓盐酸 | KMnO4 | Na2S溶液 | 氧化性:KMnO4>Cl2>S | |
| C | 浓氨水 | NaOH | 酚酞 | 碱性:NaOH>NH3•H2O | |
| D | 浓硫酸 | Na2SO3 | BaCl2溶液 | SO2与可溶性钡盐均不反应 |
| A. | A | B. | B | C. | C | D. | D |
1.前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2•H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体.已知H2O2的结构式为H-O-O-H,下列说法中不正确的是( )
| A. | H2NCONH2与H2O2是通过氢键结合的 | B. | H2O2分子中只含σ键,不含π键 | ||
| C. | H2O2既有氧化性又有还原性 | D. | H2NCONH2•H2O2属于离子化合物 |
8.下列各组离子在酸性溶液中能大量共存的是( )
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、Cl-、Ca2+、Na+ | D. | Fe2+、Na+、Cl-、NO3- |
18.表是元素周期表的一部分,有关说法正确的是( )
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | |||||
| 3 | a | b | e | f |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a、b、e三种元素的原子半径:e>b>a | |
| C. | 六种元素中,c元素单质的化学性质最活泼 | |
| D. | c、e、f的最高价氧化物对应的水化物的酸性依次增强 |
5.同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A. | 原子半径:X>Y>Z | B. | 单质的非金属性:X>Y>Z | ||
| C. | 气态氢化物稳定性:X<Y<Z | D. | 原子序数:X>Y>Z |
2.在下列元素中,不属于主族元素的是( )
| A. | 氢 | B. | 钙 | C. | 铁 | D. | 碘 |

